Lunsumio, Krazati 등 항암 신약 9개, 전체 24% 차지
연 2회 투여 HIV 치료제 Sunlenca, 한미약품 기술이전한 롤베돈 허가

올해 미국 FDA 허가 의약품이 37개로 마무리됐다. 이는 예년에 비해 13개 감소한 수치다.
미국 FDA가 30일까지 기관 홈페이지를 통해 공개한 CDER(약물 평가 및 연구 센터, Center for Drug Evaluation and Research) 허가 품목은 37개로 확인됐다. 이는 CBER에서 담당하고 있는 백신, 유전자 치료제, 긴급사용승인(EUA) 품목은 제외된 개수다.
최근 10년 중 2013년 27개, 2016년 22개 신약 허가건 다음으로 적은 기록이다. FDA는 2017년 이후로 40~50개 신약 허가 건수를 기록하고 있었기 때문에, 내년 1월 발행 예정인 FDA 신약 허가 분석 보고서에서 이 내용이 다뤄질 것으로 전망된다.
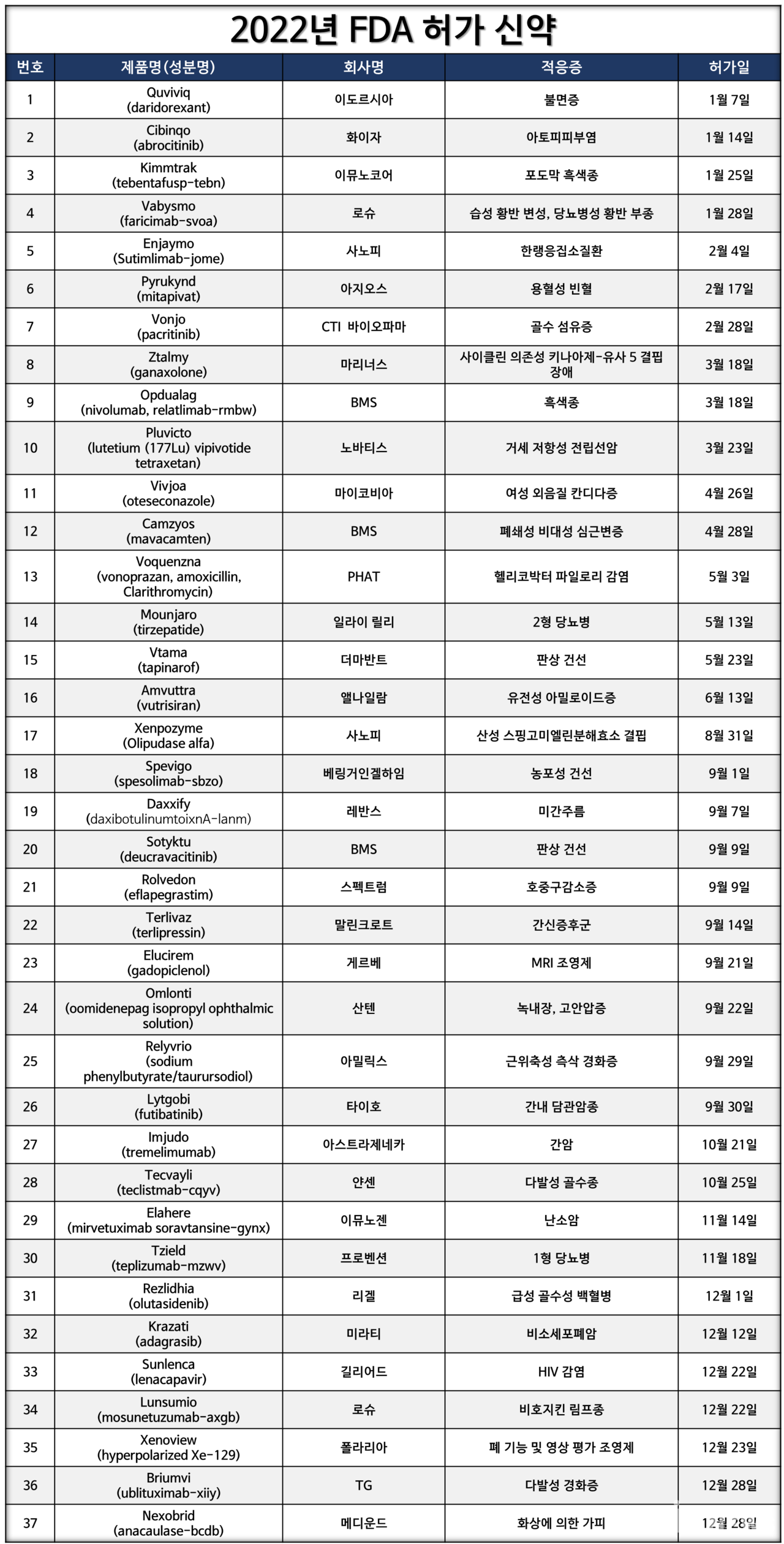
올해 FDA 허가 신약은 불면증, 아토피피부염, 각종 암종, 판상 건선, 당뇨병 등 다양한 적응증을 대상으로 허가됐다.
이 중 항암제는 △Lunsumio(로슈) △Krazati(미라티) △Elahere(이뮤노젠) △Tecvayli(얀센) △Imjudo(아스트라제네카) △Futibatinib(타이호) △Pluvicto(노바티스) △Opdualag(BMS) △Kimmtrak(이뮤노코어) 등 9개 품목(24%)이었다.
대상 적응증은 비호지킨 림프종, 비소세포폐암, 난소암, 간암, 다발성 골수종, 간내 담관암, 전립선암, 흑색종 등이다.
연 2회 투여로 복약 편의성을 개선한 길리어드의 HIV 치료제 ‘Sunlenca’도 허가됐다.
이 약은 기존 2개월에 한 번 투여할 수 있었던 경쟁약 ‘카베누바(비브)’보다 투여기간을 3배 가량 증가시켰다.
이 약물은 HIV-1 바이러스 캡시드와 결합해 바이러스가 숙주 핵 내부로 침투하는 것을 막고, 바이러스의 DNA 중합, 전사 과정을 억제하는 기전을 가진다.
한미약품이 스펙트럼에 기술이전한 호중구감소증 치료제 롤베돈(국내 제품명 : 롤론티스)도 신약 명단에 이름을 올렸다.
스펙트럼은 2018년 12월, 국내보다 먼저 미국 FDA에 BLA(생물학적 제제 품목허가)를 신청해 품목허가를 진행했지만, 2번의 CRL(Complete Response Letter, 자료보완요구서)을 요청받아 허가가 지연된 바 있다.
이 제품은 지난 9월 최종 허가에 성공했으며, 지난 10월 23일을 기점으로 미국 전역에서 판매 중이다.

