올 한해 604건 승인… "치료방법 없을 때 제공"
아직 개발 중인 의약품을 식약당국 승인 하에 예외적으로 환자에게 사용한 건수가 올 한해 604건에 달하는 것으로 집계됐다.
식품의약품안전처는 생명이 위급하거나 다른 치료방법이 없는 환자에게 치료기회를 제공하기 위해 전문의의 판단 아래 임상시험용의약품을 무상으로 투여할 수 있도록 승인하는 응급상황 및 치료목적 사용 승인제도(응급임상, 이하 '치료목적 사용승인')를 2002년부터 운영 중이다.
'개인별 환자를 위한 임상시험용의약품 치료목적 사용승인'과 '다수 환자를 위한 임상시험용의약품 치료목적 사용승인'으로 나뉜다.

개인별 환자를 위한 사용승인의 신청주체는 의료기관의 주치의이며, 민원처리 규정에 따라 식약처는 7일 이내에 처리해야 한다. 다수 환자를 위한 사용승인의 신청주체는 해당 임상시험용의약품 개발을 책임지고 있는 제약회사다. 30일 이내 식약처가 처리하도록 돼있다.
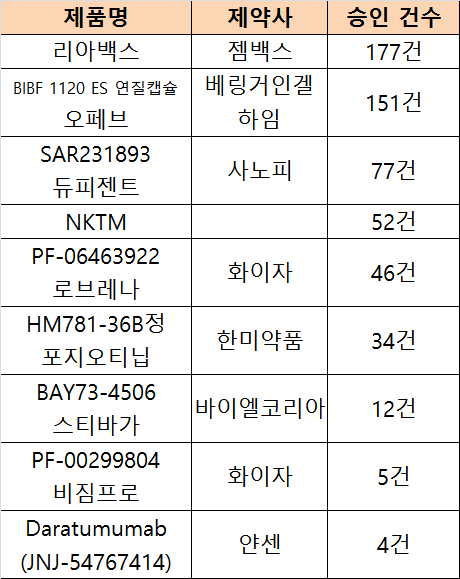
응급상황 및 치료목적 사용 승인 현황 상위 9개 품목
(2018.11.13. 기준)
식약처는 작년 8월부터 환자나 보호자가 승인받은 임상시험용의약품 코드명, 대상 질환, 사용되는 병원 등을 손쉽게 확인할 수 있도록 '치료목적 사용승인' 현황을 홈페이지를 통해 공개하고 있다.
히트뉴스가 2016년 1월 1일부터 현재까지 누적된 데이터를 토대로 분석한 결과, 총 2100건이 치료목적으로 사용 승인된 것으로 조사했다. 연도별로 보면 2016년 793건, 2017년 703건, 2018년은 현재까지 604건이었다.
올해 승인된 약제를 보면, 젬백스앤카엘이 개발 중인 리아백스주가 177건으로 가장 많았다. 리아백스 주는 췌장암 치료제로, 3상 임상시험을 조건으로 허가 받은 국내개발 21호 신약이다.
인간 텔로머라제에서 유래한 16개의 아미노산으로 구성된 펩타이드(peptide)로 체내의 면역세포를 활성화시켜 암세포를 공격하는 기전의 신개념 면역항암제다.
기존 화학치료제와 병용 투여 시 바이오마커인 이오탁신(eotaxin)이 높은 췌장암 환자의 생존기간을 연장시켜 주는 것으로 알려졌다.
리아백스주의 응급임상 사용 현황을 살펴보면, 2014년 5건을 시작으로 2015년 52건, 2016년 60건, 2017년 95건에 이어 올해에는 177건(2018년 11월 기준)으로 늘었다. 췌장암은 물론 위암, 담관암, 유방암, 위암, 난소암, 신장암, 담도암, 폐암 등의 다양한 암종에 사용되고 있다.

젬백스 자회사인 삼성제약 측은 "응급임상을 진행하기 위해서는 적지 않은 비용이 들지만 회사는 앞으로도 최선을 다해 지원할 것이며, 현재 다양한 암종에서 사용이 증가하고 있는 리아백스주의 임상적 의의를 연구해 적응증이 확대될 수 있도록 노력하겠다"고 밝혔다.
다음은 한국베링거인겔하임의 특발성폐섬유증(IPF) 치료제 오페브 연질캡슐(BIBF 1120 ES 연질캡슐)로 151건이 승인됐다. 오페브는 지난 해 2월 비급여로 국내에 출시됐다. 이후 지난 3월 FDA로부터 간질성 폐 질환 관련 전신성 경화증 치료제로 개발을 진행하기 위한 패스트트랙(Fast Track) 대상으로 지정받았다.
이어 사노피의 SAR231893(듀피젠트)와 자가유래활성화림프구(NKTM) 각각 77건과 52건, 화이자 PF-06463922(로브레나) 46건, 한미약품 HM781-36B정(포지오티닙) 34건, 바이엘코리아 BAY73-4506(스티바가) 12건, 화이자의 PF-0029-9804(비짐프로) 5건, 얀센의 Daratumumab(JNJ-54767414) 4건 등의 순으로 뒤를 이었다. 이외 신약들은 3건 이하였다.
한편, 질환별 사용용도에서는 특발성 폐섬유증이 151건으로 가장 많았고, 다음은 췌장암 52건, 비소세포폐암 31건, 유방암이 22건 등의 순이었다.


다른 질환에 응급임상을 한다 뭐 그렇겠거니 하겠는데 알츠하이머에서 응급임상에 참여한다 이건 뭐 획기적이라고 할 수 밖에 왜냐하면 알츠하이머 약은 지금까지 없었기 때문이다. 다국적 제약사들이 다 손을 들은 이 상황에 도네페질이라고 있으나 그건 진행을 늦춰준다고 알려졌을 뿐 헌데 리아백스주로 알츠 응급임상에 참여한다는 것 이건말이지 최소한 도네페질보다 효과가 없다면 또 알츠하이머 개선효과의 확신 없이는 환자도 의사도 시도할 이유가 없는게지 이런걸 우리 환자들은 궁금해 하는데 아니 목이 빠져라 기다리고 있는데 기자들은 간과하거든 전문지식이 떨어지거나