원개발사 파마마, 국내 개발과 판매 독점 권한 계약
한국얀센, 크론병 트렘피어·심퍼니 병용요법 2상 승인


지난주(9월 19일~9월 25일) 22개 품목이 식품의약품안전처에서 허가받았다. 전문의약품은 15건, 일반의약품은 7건이었다.
국내 제약사 중 항암제 분야를 리드하고 있는 보령이 소세포폐암 신약 젭젤카(성분 러비넥테딘)을 허가받았다.
1차 백금기반 화학요법에 실패한 전이성 소세포폐암 효능효과로 허가됐으며 효능효과는 반응률과 반응기간에 근거해 아직 생존기간을 입증한 자료는 없다.
소세포폐암은 폐암의 15~20%에서 진단되며 일반적으로 경과가 좋지 않아 진단 시 이미 전이가 발견되는 경우가 많다. 그에 따라 5년 생존율 또한 6% 수준으로 매우 낮다.
현재 소세포폐암 치료제로 사용되는 품목으로는 종근당 캄토벨(성분 벨로테칸), 한국노바티스 하이캄틴(성분 토포테칸) 등이 있다.
젭젤카는 국내에서 2020년 희귀의약품 지정을 받았으며 FDA에서는 같은 해에 전이성 소세포폐암(SCLC) 성인 환자에 대한 2차 치료제로 허가받았다.
젭젤카의 원개발사는 스페인 제약사인 파마마다. 보령은 지난 2017년 파마마로부터 젭젤카의 국내 개발과 판매 독점 권한을 계약했다.
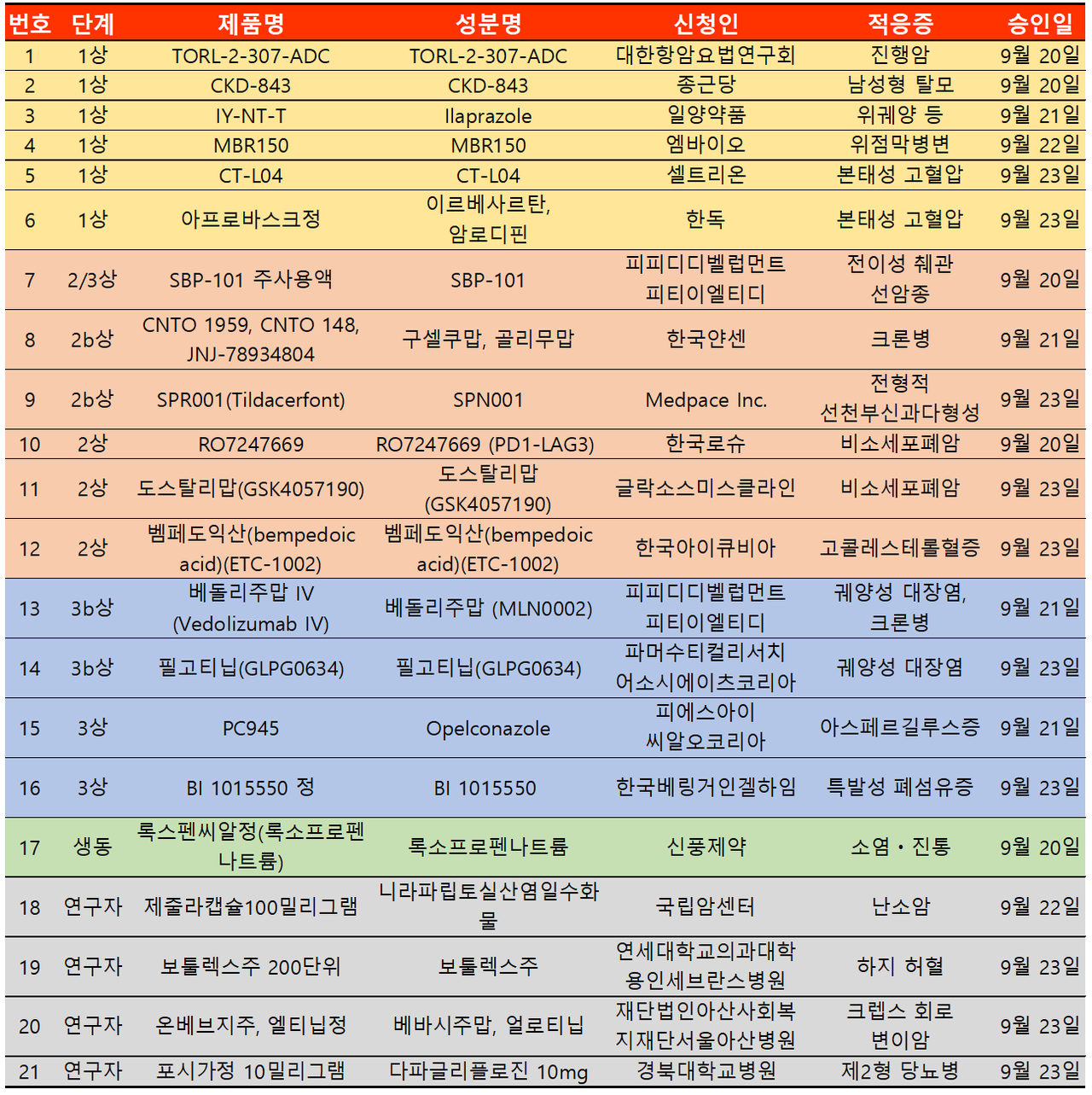
지난주 임상시험계획은 총 21건이 승인됐다. 임상1상 6건, 2상 6건, 3상 4건, 생동 1건, 연구자 4건 등이다.
염증성 장질환 관련 임상이 3건 승인됐다. 한국얀센은 크론병에서 트렘피어(성분 구셀쿠맙)과 심퍼니(성분 골리무맙)의 병용요법으로 임상 2상을 승인받았다.
인터루킨 억제제인 트렘피어와 TNF-α 억제제인 심퍼니의 병용요법인 만큼 주목을 받고 있다. 실제로 올해 5월 열린 대한장연구학회 국제학술대회에서는 궤양성 대장염 치료 부분으로 임상결과가 발표된 바 있다.
크론병과 궤양성대장염 치료제인 한국다케다제약 킨텔레스(성분 베돌리주맙)는 소아 환자에서 정맥내 투여의 장기 안전성을 평가하기 위한 제3b상 연장 임상시험을 승인받았다.
소아 환자 대상인 만큼 다국가로 진행되지만 전체 시험대상자수는 93명이며 국내 환자는 3명이 참여할 예정이다.
한국에자이 지셀레카(성분 필고티닙) 또한 임상적 관해 상태의 궤양성 대장염 시험대상자에서 경구 투여 용량 감량의 유효성 및 안전성을 평가하기 위한 임상시험을 승인받았다.

