HER2 대상 치료 두 번 이상 받은 전이성 유방암·위암 환자 치료 사용
"기존 치료 어려운 HER2 발현 유방암·위암 환자에 새로운 기회 제공"
한국다이이찌산쿄사(대표 김대중)와 한국아스트라제네카(대표 김상표)가 공동 개발한 HER-2(사람상피세포성장인자수용체-2) 저발현 유방암 치료제 '엔허투(성분명 : 트라스투주맙데룩스테칸)'가 19일 국내 허가됐다.
해당 품목은 식품의약품안전처가 작년 6월 신속심사에 착수해 허가심사를 진행했지만, 추가 검토가 이어지며 국민동의청원과 환자단체 간담회 등에서 허가 촉구가 이어진 바 있다.
'엔허투주100mg'는 이전에 HER2 대상 치료를 두 번 이상 받았던 전이성 유방암·위암 환자의 치료에 사용되는 3차 치료제로 허가받았다.
구체적 허가 효능·효과는 △이전에 두 개 이상의 항 HER2 기반 요법을 투여받은 절제 불가능한 또는 전이성 HER2 양성 유방암 환자의 치료 △이전에 항 HER2 치료를 포함하여 두 개 이상의 요법을 투여받은 국소 진행성 또는 전이성 HER2 양성 위 또는 위식도접합부 선암종의 치료 등이다.
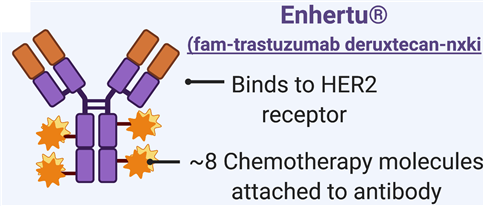
이 치료제는 항체와 약물이 각각 고유의 활성을 나타내는 ADC(항체-약물 접합체) 의약품으로 개발됐다. 항체(트라스투주맙)는 HER2 발현 종양을 특이적으로 표적화하며, 약물(데룩스테칸)은 세포 증식 억제와 종양 세포 사멸 유도하는 작용기전을 가진다.
식품의약품안전처 첨단제품허가담당관 김남수 과장은 "엔허투주는 기존 치료제로 치료가 어려운 HER2 발현 유방암·위암 환자에게 새로운 치료 기회를 제공할 것으로 기대된다"고 말했다.
한편, 국내에서 3차 치료제로 허가된 것과 달리 FDA와 EMA는 현재 엔허투의 'HER2 양성인 진행성 유방암 환자의 2차 이상 치료'와 '절제불가능하거나 HER2 저발현 HR 양성 혹은 음성인 전이성 유방암 환자 치료'에도 허가된 상태다.

