12일까지 회수 계획서 제출, 결과보고서는 30일 이내 제출
"임상시험 재평가 이의신청서 유효성 입증 추가 자료 제출 못해"

뇌기능개선제 '아세틸-엘-카르니틴'이 임상시험 재평가 이의신청서 유효성을 입증할 만한 추가 자료를 제출하지 못해 결국 회수 조치된다.
신경승 식품의약품안전처 의약품안전평가과 과장은 "한 개 업체의 이의신청이 제기됐지만, 약사심의위원회와 자문단 논의 결과 기존 제출자료 대비 유효성을 입증할 만한 추가 자료가 없다고 판단돼 회수를 결정했다"고 밝혔다.
업계 관계자에 따르면, 한미약품이 이 성분 제제 취급 업체들을 대표해 이의신청기간 내 식약처에 의견서를 제출한 것으로 나타났다.
반면 식약처는 7일 재평가에 따른 정부회수 조치로, 각 지방청에 아세틸-엘-카르니틴 성분 제제 취급 제약사들에게 회수계획서 제출을 요청하도록 지시했다. 계획서 제출일은 오는 12일까지며, 대상은 30개 제조사, 33개 품목이다.
이인선 식약처 의약품안전평가과 사무관에 따르면, 회수 결과보고서 제출은 회수계획서 제출일로부터 30일 내로 진행돼야 한다. 회수계획서 제출 전에도 회수 진행은 가능하며, 업체 측이 결과보고서 제출 예정일까지 제출할 수 없는 경우 '사유'와 '예상 제출일'을 보고하면 연장 가능하다.
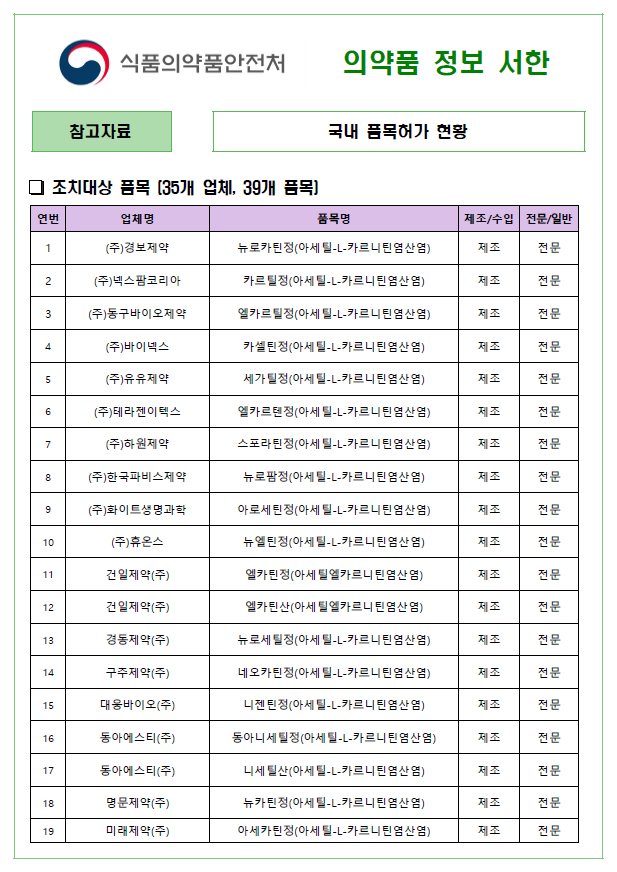
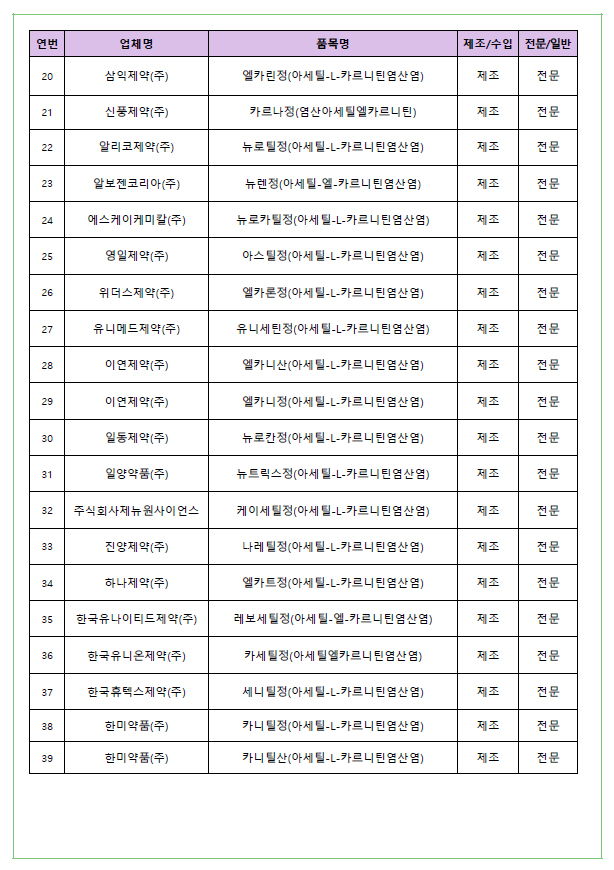
식약처는 지난달 5일 '아세틸‐엘‐카르니틴' 제제가 임상시험 재평가에서 유효성을 입증하지 못했다며, '의약품 안전성 정보 서한'을 통해 '뇌혈관 질환에 의한이차적 퇴행성 질환 치료' 목적에 이 성분 제제 처방·조제 금지 및 대체의약품 사용을 권고한 바 있다. 조치 대상은 35개 제조사, 39개 품목이었다.
한편 시장조사기관 유비스트에 따르면, 지난해 '아세틸-엘-카르니틴' 원외처방액 규모는 약 511억 원이었다. 이 중 점유율 1위 제품은 한미약품 '카니틸정'로, 지난해 원외처방액은 약 176억 원이었다.
관련기사
- 콜린 처방 지속 증가... 아세틸-엘-카르니틴 시장도 흡수하나
- 아세틸-엘-카르니틴, 급여중지 시기 놓고 혼선
- 아세틸-엘-카르니틴, 결과공시 20일... 사실상 허가취소 수순
- 내년 급여재평가 아세틸-엘-카르니틴, 임상재평가서 '아웃'
- '아세틸‐엘‐카르니틴' 유효성 입증 못 해...5일부터 처방·조제 중지
- 롤론티스 FDA 허가에 로수젯 란셋 등재 청신호 켜진 한미
- 아세틸-엘-카르니틴 급여도 중지... 급여청구 유예 '글쎄'
- 뇌기능개선제 잇딴 수난... 사미온30mg 대안 떠올라
- 올해 식약처 회수명령 1위 '한약제제 품질시험 미실시·미비'
- 뇌기능개선제 옥시라세탐 임상재평가 결과... 식약처 "검토 중"
- 임상재평가 결과 다음 발표 대상 '날록손·세프테졸' 유력

