장기추적조사 대상, 기간 및 보고서 작성방법 등 안내
"현재까지 장기추적보고 대상 품목은 10개 채 안돼"

장기추적조사 이행·평가 결과보고(이하 장기추적 결과보고)를 해야하는 첨단바이오의약품들이 속속 등장하자, 식약처가 조사대상·기간 및 보고서 작성방법 등을 안내한 가이드라인을 제정·발표했다.
첨단바이오의약품 장기추적조사 제도는 줄기세포 또는 유전물질이 포함된 첨단바이오의약품을 투여받은 환자의 안전을 확보하기 위해 투여 후 장기간 동안 암 등 이상사례 발생 여부를 추적‧조사하는 제도다.
식약처 바이오생약국 첨단바이오의약품TF 관계자는 히트뉴스에 "장기추적 결과보고는 최초 판매·공급일로부터 1년 후부터 이뤄져야 하기 때문에 올해 처음 보고되기 시작했다"며 "현재 장기추적조사 이행·평가 결과를 보고한 첨단바이오의약품은 10품목이 채 되지 않는다"고 밝혔다.
즉, 장기추적 결과보고를 규정하고 있는 △첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 △동 시행령 △첨단바이오의약품 안전 및 지원에 관한 규칙 △첨단바이오의약품 품목허가·심사 규정 △첨단바이오의약품 장기추적조사 관리 기준’이 이미 2020년 8~9월(시행령은 동년 12월)시행됐지만, 판매·공급기간 1년이 지난 품목이 올해부터 나오기 시작해 가이드라인을 만들어 이를 지원하고자 했다는 것이다.
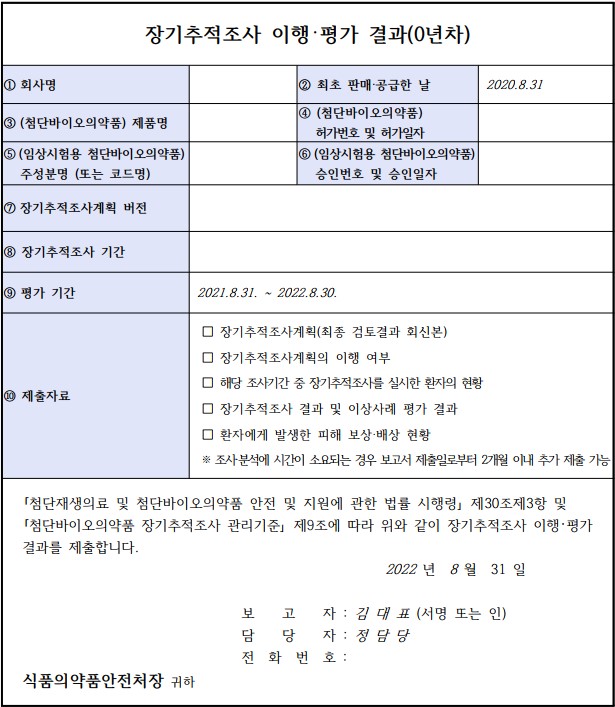
8월 31일 제정된 이 가이드라인 주요 내용은 △조사대상 △조사기간 △조사내용 △보고서 작성방법 등을 포함하고 있으며, 제출자료로 △장기추적조사계획 △장기추적조사계획의 이행여부 △해당 조사기간 중 장기추적조사를 실시한 환자의 현황 △장기추적조사 결과 및 이상사례 평가 결과 △환자에게 발생한 피해 보상·배상 현황 등이 필요하다고 명시돼 있다.

가이드라인에 따르면, 모든 첨단바이오의약품이 장기추적조사 대상은 아니다. 장기추적조사로 지정돼야 하며, 그 대상은 △줄기세포치료제 △유전자치료제 △이종이식제제 등이다. 작년 장기추적조사 대상 지정건수는 약 30건이었다.
또한 장기추적조사 계획을 수립한 뒤 식약처에 검토를 받고, 판매·공급투여 등록 후부터 정해진 시기에 이행평가결과 및 중대한 이상사례를 보고해야 한다.
최초 보고 이후 매년 1년마다 정기보고를 식약처장에게 보고해야 하며, 마지막 장기추적조사일 후 6개월 째 최종보고를 해야 한다. 장기추적조사 기간은 줄기세포치료제 5년, 유전자치료제 15년, 이종이식제제 30년이다.
첨단바이오의약품TF 관계자는 "품목허가 후 바로 투여돼 장기추적조사 기간이 적용될 수도 있지만, 급여등재 후에야 공급이 시작되는 품목도 있기 때문에 허가 시점보다 1~2년 후 최초 장기추적 결과보고가 이뤄진다고 본다"고 설명했다.
식약처는 가이드라인 외에도 '첨단바이오의약품 장기추적조사 분야 자주묻는 질의응답집'을 31일 발간했다.
이 질의응답집은 △첨단바이오의약품 장기추적조사 제도 도입 취지 △장기추적조사 지정 대상, 기간 △장기추적조사 계획부터 이행·평가 결과 보고까지 내용과 방법 △투여환자에 대한 투여 내역 등록 방법 등이 기재돼 있다.
김상현 첨단바이오의약품TF 팀장은 "이번에 발간된 질의응답집과 가이드라인이 첨단바이오의약품을 투여받은 환자의 안전을 확보하는 데 도움을 줄 것으로 기대한다"며 "첨단재생바이오법 관련 제도가 안정적으로 정착될 수 있도록 필요한 정보를 지속적으로 제공하겠다"고 밝혔다.
한편, 우리나라 최초의 첨단바이오의약품 허가 품목은 CAR-T 항암제 '킴리아(성분명 : 티사젠렉류셀)'로 2021년 3월 허가됐다. 이에 킴리아는 동시에 1호 장기추적조사 대상으로 지정돼, 올해 장기추적 결과보고를 수행했다.