현재 웹사이트 내 공고 중 , 오는 9월부터 내년 7월까지 시행
국가신약개발사업 중 비임상·1상 과제 지원 대상
"Pre-IND 등 면담제도 활용·지원해, 심사 과정 단축토록 할 것"

국가신약개발사업단(KDDF)이 국내 신약 연구개발 기업의 글로벌 시장 진출을 도모하기위해 FDA Pre-IND 미팅(임상시험계획 사전 미팅) 등 해외 규제기관과 인허가(RA, Regulatory Affairs) 업무를 지원하는 '글로벌 RA 지원사업'을 시작한다.
허성오 KDDF R&D사업본부장은 11일 '글로벌 RA 지원사업 설명회'에서 글로벌 RA 지원사업 필요성 및 지원항목 등 핵심 내용을 소개했다.
허 본부장은 "국내신약개발 과제 결과물의 해외 진출 과정에서 RA는 넘어야 할 중요한 허들"이라며 "글로벌 혁신신약의 RA지원을 통해 신약개발 가능성을 제고할 계획"이라고 사업배경을 밝혔다.
그는 "이번에는 해외 규제기관 중 FDA를 대상으로 진행할 예정"이라며 "FDA 규제 및 실무에 대한 이해도가 높은 전문 사업수행기관을 활용해 국내 기업을 지원하려고 한다"고 덧붙였다.
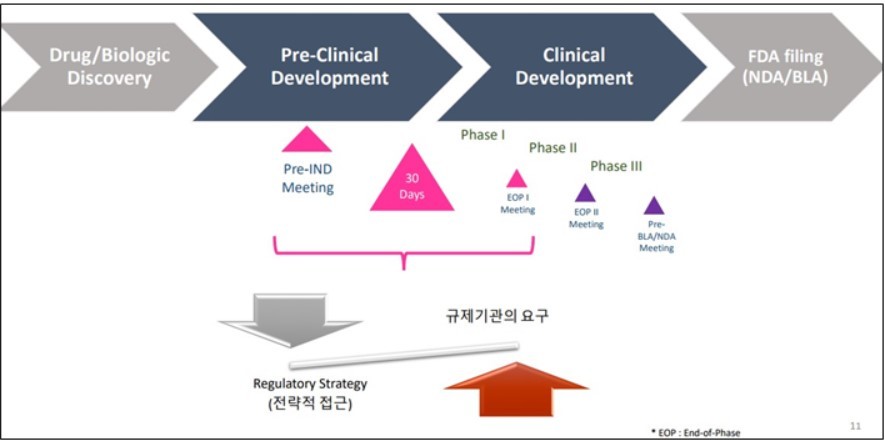
글로벌 RA 지원사업은 현재 KDDF 웹사이트 내에서 공고 중이며, 9월부터 내년 7월까지 시행된다. 지원 대상은 '국가신약개발사업' 중 비임상 및 임상 1상을 진행 중인 과제에 한한다.
KDDF 측은 기본 지원 요건 외에도 지원 회사의 비임상 데이터 완성도, 미국 진출 시 성공 가능성(혁신성) 등에 대해 외부 평가 위원회를 평가를 통해 선정할 예정이다.
해당 지원 사업에 선정된 업체들은 △Pre-IND 미팅 업무지원 △IND 서류화 및 관리(filing and management) △시놉시스 개발(Synopsis development) 자문 △기타 미국 FDA IND 및 NDA(품목허가) 대비 사전 준비 자문 등 4가지 지원항목 중 1개 항목에 한해 지원받을 수 있다.
Pre-IND 미팅 업무지원은 FDA 가이드라인에 따른 요청서 제출과 회의자료 검토 및 제출, Pre-IND 미팅 수행 과정까지가 포함되며, IND 서류화 및 관리는 IND를 위한 제반 서류 패키지 및 프로젝트 관리, eCTD(전자 공통기술문서) 제출까지 지원된다.
또한, 시놉시스 개발 자문도 중요한 지원항목으로 소개됐다. 시놉시스는 임상시험을 전반적으로 요약한 일종의 개요(Abstract)다.
허 본부장은 "FDA 신약 허가를 전략적으로 취득하기 위해선, 공식적인 면담제도를 적극 활용해 불필요한 시간과 비용 절감 등 심사 과정을 단축할 수 있어야 한다"면서 "다만, 국가신약개발 과제 201개 업체 중 이런 공식 면담제도를 독자적으로 진행할 수 있는 회사는 거의 없다"고 밝혔다.
허 본부장에 따르면, 2010~2012년 사이 FDA 품목 허가된 의약품의 평균 개발 시간은 Pre-IND 미팅을 수행하지 않은 경우(12.8년)가 수행한 경우(7.1년)에 비해 5.7년 길었다.
그는 "FDA의 리뷰팀 등 다양한 규제담당자들과의 커넥션을 데드라인 내 원활히 진행할 수 있도록 KDDF가 전문가를 마련해 지원할 것"이라고 말했다.
한편, KDDF가 운영하고 있는 국가신약개발사업은 10년을 계획기간으로 진행된다. 연간 예산은 1500억 원으로, 동 성격의 사업 중 최대 규모의 예산을 보유하고 있다.
허 본부장은 "사업단 비전은 향후 10년 간 FDA 및 EMA에 허가받은 신약을 4종, 글로벌 시장에서 1조원 이상 매출 성과를 내는 신약 1종을 배출하는 게 목표"라며 "연 매출 7조원 이상의 글로벌 30위권에 드는 '박세리 기업'이 1~2개 사가 탄생하는 것도 가능할 것"이라고 전망했다.

