림프종 적응증서 '파베젤리맙' 3상, '티슬레리주맙' 연구자 승인
고지혈증치료제, 930억 시장 페노피브레이트 단일·복합제 허가

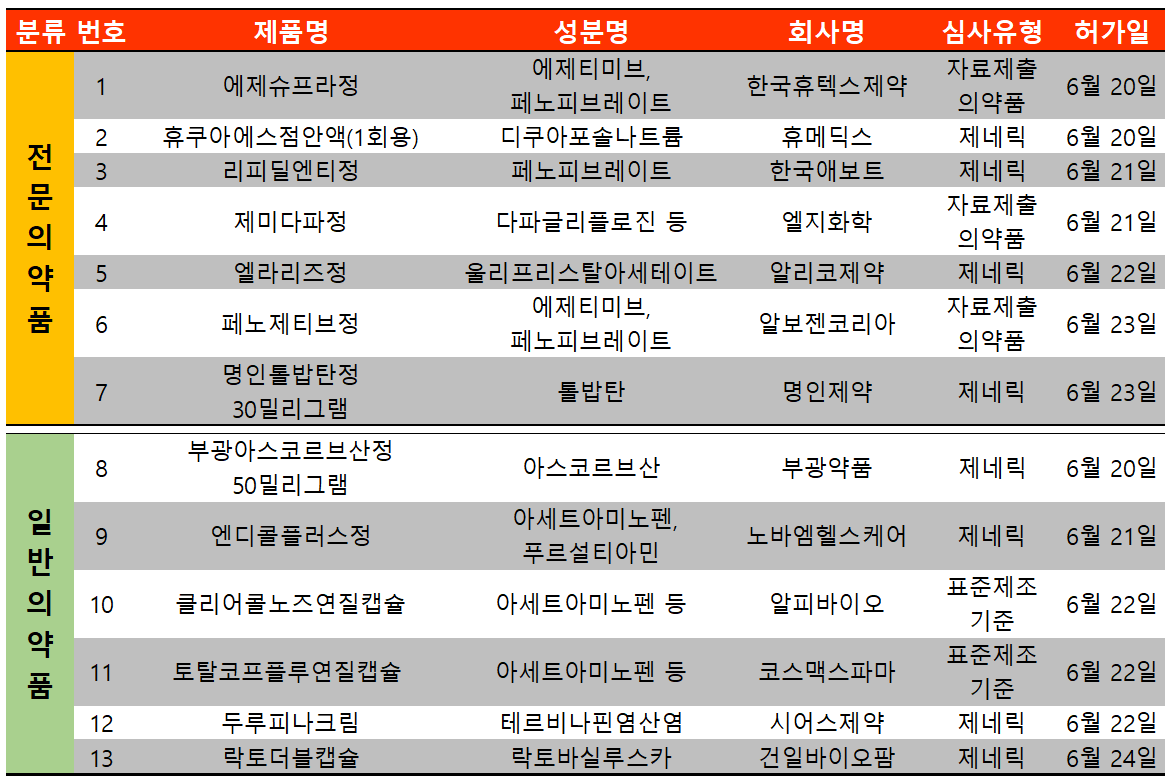
지난 주(6월 20일~6월 26일)에는 총 13개 품목이 식품의약품안전처로부터 허가받았다. 이 중 전문의약품은 7건, 일반의약품은 6건이었다.
허가받은 전문의약품 7건 중 3건이 고지혈증 치료 관련 품목이었다. 2022년 2월 국내에서 처음으로 에제티미브-페노피브레이트 성분 복합제인 현대약품 '에제페노'가 급여등재된 이후 6월에 연달아 한국휴텍스제약 '에제슈프라'와 알보젠코리아 '페노제티브'가 허가받았다.
그 외 고지혈증 치료제인 한국애보트 리피딜엔티가 페노피브레이트 단일 성분으로 허가받았다. 애보트는 기존 페노피브레이트의 오리지널 의약품인 '트리코'를 가지고 있으나 국내에는 허가되지 않았다.
페노피브레이트는 고지혈증 치료제이다. 지질단백질을 분해하는 여러 효소의 작용을 도와주어 콜레스테롤이나 중성지방 등 혈액 중 지질 관련 수치들을 낮춰준다. 고지혈증 및 이상지질혈증 환자의 콜레스테롤 감소를 위한 식이요법의 보조제로 사용된다.
유비스트 통계에 따르면 페노피브레이트 관련 단일제 및 복합제의 원외처방액은 2021년 기준 930억 원으로 집계됐다.
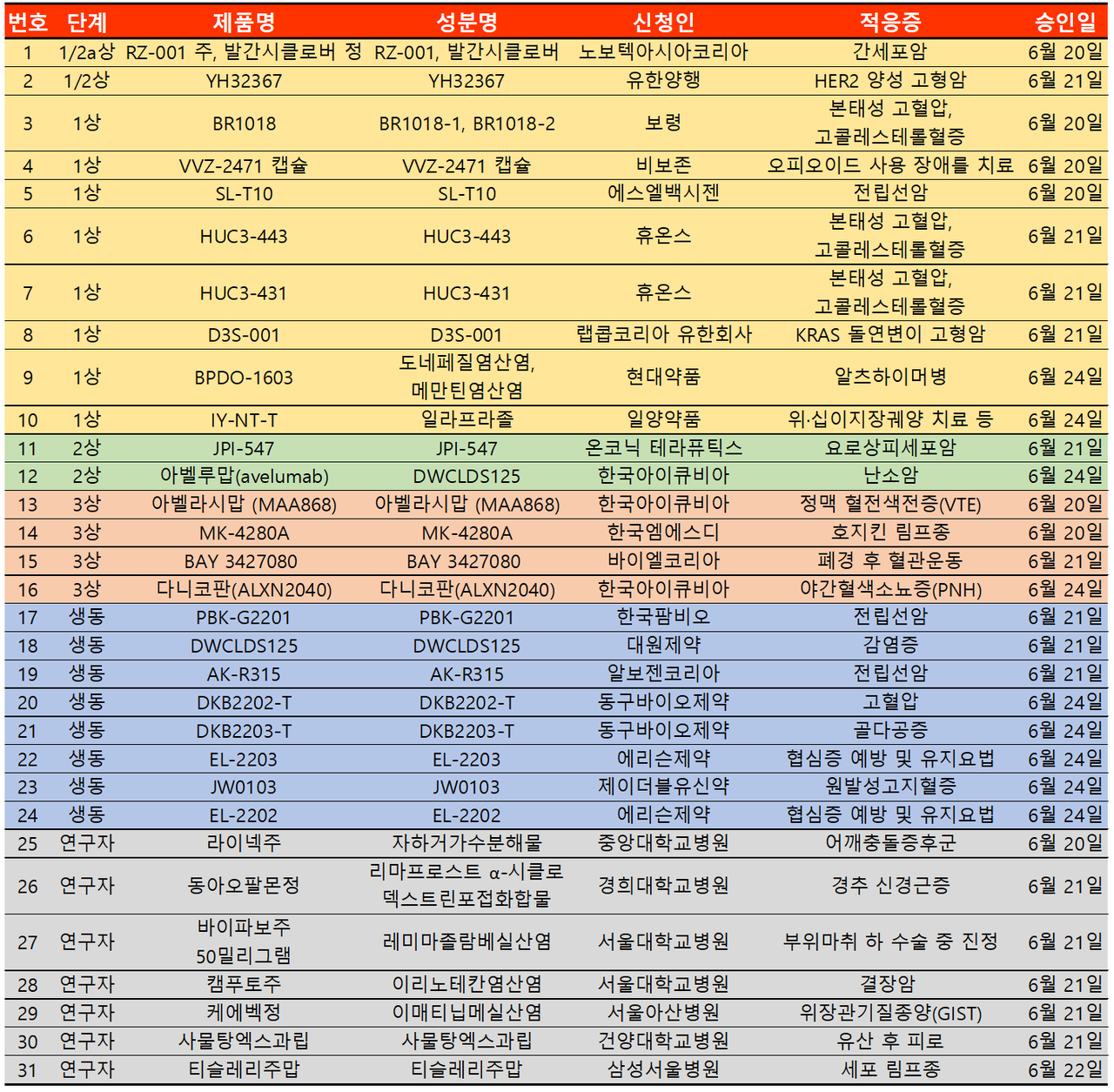
지난주 임상시험계획은 총 31건이 승인 완료됐다. 세부적으로 △임상1상 10건 △2상 2건 △3상 4건 △생물학적동등성 8건 △연구자임상 7건 등이다.
이번 임상시험은 1/3 이상이 항암제 분야에서 이뤄졌다. 1상에서 4건 2상에서 2건 3상에서 1건 생동에서 2건 연구자임상에서 2건 등 총 11건으로 전 단계에서 승인받았다.
그 중 림프종 적응증으로 한국MSD MK-4280A(파베젤리맙)는 3상으로, 베이진·노바티스 티슬레리주맙은 연구자 임상으로 승인받으며 새로운 물질 개발에 박차를 가하고 있다.
파베젤리맙이 진행하고 있는 3상 임상시험은 PD-(L)1 치료에 반응하지 않은 재발성 또는 불응성 전형적 호지킨 림프종을 대상으로 키트루다 병용요법 내용이다. 파베젤리맙의 경우 2021년에도 PD-L1 양성의 전이성 결장직장암을 대상 2차 치료제로 키트루다 병용요법과 표준치료를 비교하는 제3상 임상시험을 승인 받은 바 있다.
파베젤리맙은 MSD가 개발하고 있는 면역항암제다. 기존 PD-1 외에 LAG-3이라는 면역관문을 억제해 두가지 면역관문을 타깃하려는 것이 MSD의 목표다.
티슬레리주맙은 삼성서울병원에서 연구자 임상시험으로 이전에 치료 기왕력이 없는, 처음으로 진단된 1, 2 병기 림프절 외 NK/T세포 림프종, 비강형에서 방사선 병합요법의 효과 및 안전성 검증을 위한 제2상 임상시험으로 승인받았다.
베이진과 노바티스가 공동으로 개발하고 있는 PD-1 억제제 티슬레리주맙은 유럽종양학회 학술대회(ESMO), 미국임상종양학회 연례학술대회(ASCO) 등에서 재발성·전이성 비인두암의 1차 치료제 사용으로 진행된 3상 임상시험 결과를 발표한 바 있다.
특히 1차 평가변수를 충족시키고 무진행 생존기간(PFS)를 개선했으며, 10개월간의 추적기간 결과 또한 긍정적으로 나타나 주목받고 있다.

