식약처, 지난 5월 31일 제정된 식약처 고시 내용 반영
수송설비 검증 계획서·보고서 등 SOP 예시 양식 첨부

생물의약품 제조·수입·도매상(이하 판매자)을 대상으로 한 보관 및 수송 관리 가이드라인 개정과 함께 대상 업체들이 참고할 수 있는 수송설비 검증 관련 내부 표준운영절차(SOP, Standard Operation Procedure) 예시 양식이 공개됐다.
식품의약품안전처는 지난 5월 31일 최근 제정·시행된 식약처 고시 '생물학적 제제 등의 보관 및 수송에 관한 규정'의 생물의약품 보관 및 수송 시 준수사항에 대한 상세 운영방안 등을 바탕으로 '생물학적 제제 등 보관 및 수송 관리 가이드라인'을 개정했다.
식약처는 이 가이드라인을 발간하며 '수송설비 검증 계획서'·'수송설비 검증 보고서' 등 사내에서 사용할 수 있는 SOP 예시 양식을 첨부해 제공했다.
개정된 가이드라인에 따르면, 생물의약품 판매자는 수송설비(수송용기, 운송차량 등)에 대해 △수송거리 △수송시간 △계절적 변동 요인 △제품 특성 등을 고려해 수송 중 적정온도가 유지되는 지 검증을 실시하고 문서화해야 한다. 또한 검증을 수행하기 전 계획을 수립해야 한다.
예시 안으로 공개된 수송설비 검증 계획서는 △목적 △범위 △책임 △기본 정보(수송설비(수송용기 또는 차량) 정보, 냉매 관리 및 포장 방법, 수송 절차) △주요 요소 검토 △검증 실시 조건 등(실시 시기, 수송거리(수송시간), 외부온도, 적재량) △검증 방법(검증 절차, 온도 모니터링 방법) △적합 판정 기준 등으로 구성됐다.
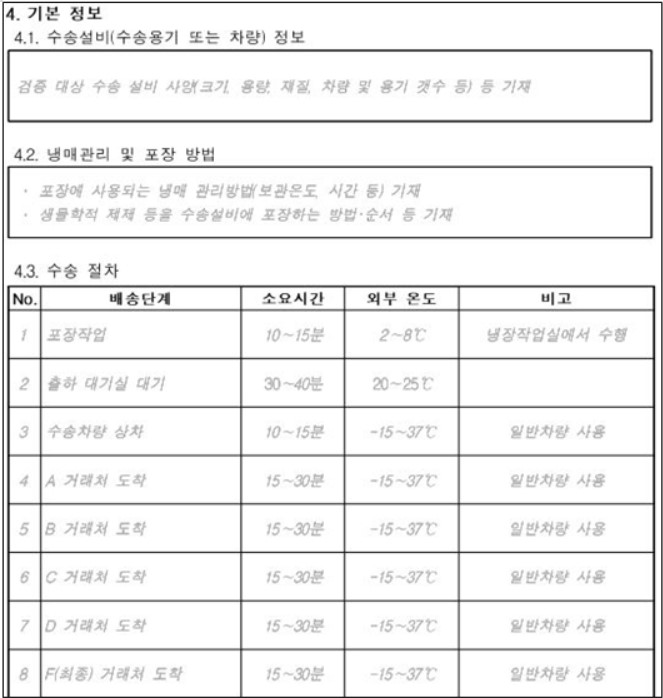
세부 항목 중 '수송 절차'는 포장 작업, 출하 대기, 상·하차 등 각 배송 단계에 따른 예상 소요시간 및 외부 온도를 기입할 수 있다. 거래처가 다양할 경우 각 거래처 별로 기입해야 한다.
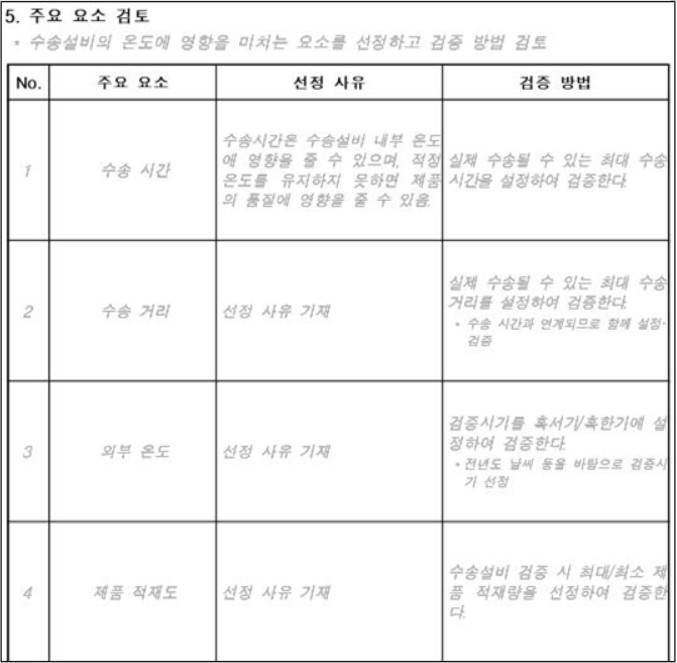
또한 실시 시기, 수송거리(수송시간), 외부온도, 적재량 등 회사가 선정한 수송설비의 온도에 영향을 미치는 주요 요소를 선정하고 검증 방법을 검토해야 한다. 검증 계획에 대한 적합판정기준도 제시되야 한다.
수송설비 검증 보고서는 계획서에 명시된 내용 중 실시 계획에 따른 검증 결과와 이에 따른 결론을 작성해야 한다는 점에서 차이가 있다. 예를 들어 온도 모니터링 결과 등을 구체적으로 기재(그림 첨부 가능)할 수 있고, 이 결과 값에 따라 적정 기준 내로 검증됐거나 재평가를 진행해야 한다고 결론지을 수 있다.
그 동안 생물의약품 판매자들은 각 고려요소 들을 검증하기 위해 필요한 시간과 인력 그리고 모호한 기준 등으로 어려움을 호소해왔다.
식약처 관계자는 히트뉴스와 취재에서 "이번 가이드라인과 예시 양식 제공으로 어느 정도 판매자들의 애로사항을 줄일 수 있을 것"이라고 전망했다.

