식약처 인공지능 의료기기 허가·심사가이드라인 살펴보니
제품 설계 변경 없이 기계학습으로 인공지능 의료기기 품질이 향상되는 경우 변겅허가 혹은 인증이 면제된다.
식약처가 12일 개정·발간한 '인공지능 의료기기 허가·심사가이드라인'에 따르면 개정판에는 기계학습 기술이 적용된 의료기기(Machine Learning-enabled Medical devices, MLMD) 정의와 특성에 따른 허가·심사 시 고려해야 할 점이 소개됐다.

IMDRF 승인한 가이드라인 속 MLMD는?
이번 가이드라인 개정은 5월9일 국제 의료기기 규제당국자 포럼(IMDRF)에서 공식 승인된 국제 공통 가이드라인과 국제조화를 위한 △의료기기에 활용되는 인공지능 기술 범위 △용어정비 등을 목적으로 이뤄졌다.
핵심은 MLMD 개념정립으로, 가이드라인에서는 기계학습 방식으로 의료용 데이터를 학습하고 특정 패턴을 인식해 질병을 진단·예측하거나 환자에게 적합한 맞춤 치료법을 제공하는 의료기기라고 명시했다.
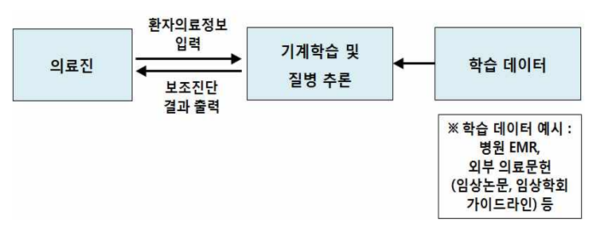
MLMD와 기존 인공지능 기반 의료기기(의료영상 분석·검출 혹은 진단보조 SW)의 가장 큰 차이점은 사용자 또는 제조자가 훈련 데이터셋을 반영할 수 있어 진단 알고리즘이 실시간으로 변경 가능하다는 부분이다.
이는 기계학습 기술이 적용된 의료기기 특징으로, 쉽게 말해 학습한 데이터를 바탕으로 민감도, 특이도 등 성능이 향상될 수 있다는 것이다. 이 같은 특성이 변경허가·인증에 반영돼야 한다는 것은 업계 오랜 요청이었다.
똑똑해진 AI는 변경허가·승인 면제 사례
이에따라 식약처는 변경허가·인증 대상 중 면제 대상을 따로 구분해 '제품의 설계 변경 없이 훈련 데이터셋이 수정·확장돼 기 허가된 정확도가 향상되는 경우'로 명시했다.
그렇지만 설계 등 제품 안전성이나 유효성에 미치는 사항이 변경되는 경우에는 임상자료나 기술문서 심사를 진행해야 하는데, 그 기준은 아래와 같다.
변경허가․인증에 대한 임상자료 심사 대상의 예시
1) 적응증이 추가돼 사용목적이 변경된 경우
2) 진단 알고리즘(기계학습 포함)이 변경돼 작용원리가 변경된 경우
3) 입력되는 의료정보의 종류가 변경돼 작용원리가 변경된 경우
4) 제공하는 결과의 종류(진단 내용, 진단 항목 등)가 변경돼 사용목적이 변경된 경우
5) 훈련 데이터셋의 변경으로 진단의 정확도가 허가·인증 시 제시된 진단의 정확도 범위 미만으로 변경되는 경우
6) 이외의 제품의 안전성 또는 유효성에 영향을 미치는 중대한 사항의 변경이 있을 경우
변경허가ㆍ인증에 대한 기술문서 심사 대상의 예시
1) 소프트웨어의 개발언어 및 운영환경이 변경돼 의료기기의 주요 성능에 영향을 미치는 변경사항인 경우
2) 임상자료 심사 대상 이외의 변경으로 주요 성능에 영향을 미치는 변경사항인 경우
*알람 기능 추가, 데이터 저장 기능 추가, 개발환경 변경, 운영환경 변경 등
사용목적이나 작용원리, 진단 정확도가 처음 허가와 동일하게 유지된다면 훈련 데이터셋 확대로 정확도가 상승할 수 있다는 것이 MLMD 특성인 만큼 이 부분이 규제에 반영된 것이다.
업계 관계자는 "인공지능 및 기계학습 기반 제품들의 강점은 학습한 결과에따라 성능이 상승될 수 있다는 부분이었지만 제도적 측면에서 이는 재허가가 필요할 수 있다는 것을 의미하기도 했다"며 "특이도, 민감도 등 정확도 상승에 대한 변경허가 면제는 필요했던 제도개선이 이뤄진 것"이라 설명했다.

