중앙약심, "10만 분의 1 원칙 지키는 선에서 허용기준 설정 필요"
발암위해도가 더 높은 물질의 섭취허용량을 기준으로 결론 날 듯

니트로사민류 불순물인 NDMA(N-Nitrosodimethylamine) 발생이 보고된 이후 국내·외 규제기관이 의약품 불순물에 대한 관리·감독이 강화되고 있는 가운데 국내 중앙약사심의위원회는 한 품목에 2개 이상 니트로사민류가 보고되는 경우 허용기준 설정을 논의했다.
박재현 식품의약품안전평가원 의약품규격과 연구관은 13일 '의약품 심사온라인 설명회'에서 "3월 중앙약심에서 실제 한 품목에 2개 이상 니트로사민류가 보고되는 경우 검출 허용기준 재설정이 필요하다는 사항이 논의됐다"고 밝혔다.
논의의 핵심은 개별 니트로사민류 불순물이 검출된 모든 니트로사민 불순물의 합으로부터 산출된 발암위해도가 10만분의 1 이하가 되도록 허용기준을 설정할 필요가 있다는 것이었다.
박 연구관은 "예를 들어, 검출된 니트로사민류 불순물 중 가장 독성이 높은 물질의 섭취허용량을 기준으로 설정하는 등 허용기준이 재설정될 수 있을 것"이라고 설명했다. 즉, 의약품에서 NDMA와 NDEA(N-Nitrosodiethylamine)가 검출된다면, 독성이 높은 NDEA로 허용 기준을 설정하는 등 재설정 기준이 마련될 것이라는 것이다.
니트로사민류 물질들은 주로 주성분과 완제 의약품 중에서 첨가제가 반응해 발생되는 것으로 보고되고 있다. 신규로 발견되는 니트로사민류 물질의 경우, 실제 발암성 시험이나 독성 자료가 굉장히 부족해 1일 섭취 용량 설정이 사실 쉽지 않은 상황이다.
그는 "이러한 의약품 중 불순물인 니트로사민류는 글로벌 이슈이기 때문에, 기준 설정 시 다른 유럽 EMA와 같은 외국 규제기관과 상호 정보 교환 등의 노력이 필요하다"며 "지속적으로 상호 정보 교환 중"이라고 밝혔다.
국내 니트로사민류 불순물 기준 설정은 원칙적으로 유전독성 불순물 관련 가이드라인인 'ICH M7(R1) 가이드라인(Assessment and control of DNA reactive(mutagenic) impurities in Pharmaceutical to limit potential carcinogenic risk)'를 따르고 있으며, 니트로사민류는 발암성이 높은 물질로 'cohort of concern(우려 집단)'으로 분류되고 있다.
니트로사민류는 개별섭취 허용량을 설정할 때 약 10만 분 1의 확률을 고려해 암이 발생할 수 있는 초과 발암위해도를 고려해 설정한다. 즉, 10만 분의 1의 확률로 암이 나타날 확률로 관리한다는 것이다.
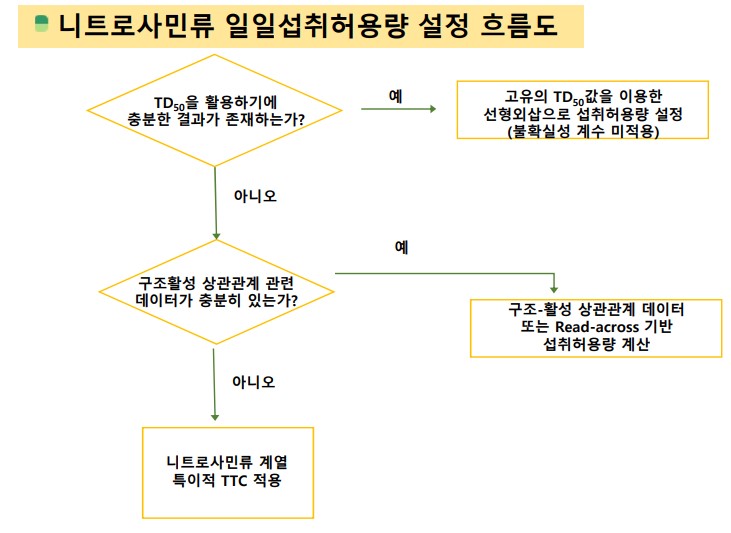
이 기준 설정방법은 3단계 중 한 단계로 진행된다. 1단계는 발암성 시험 DB(예 : Carcinogenic Potency Database)의 신뢰성 있는 TD50(실험대상 중 50%가 암이 발생하는 농도) 값이 이용 가능한 경우이며, 2단계는 화합물 특이적 발암성시험자료 TD50 값이 이용가능하지 않은 경우, 구조 활성상관관계(QSAR, Read-across 방법)를 이용해 참조물질의 발암성시험 TD50을 활용하는 경우를 말한다.
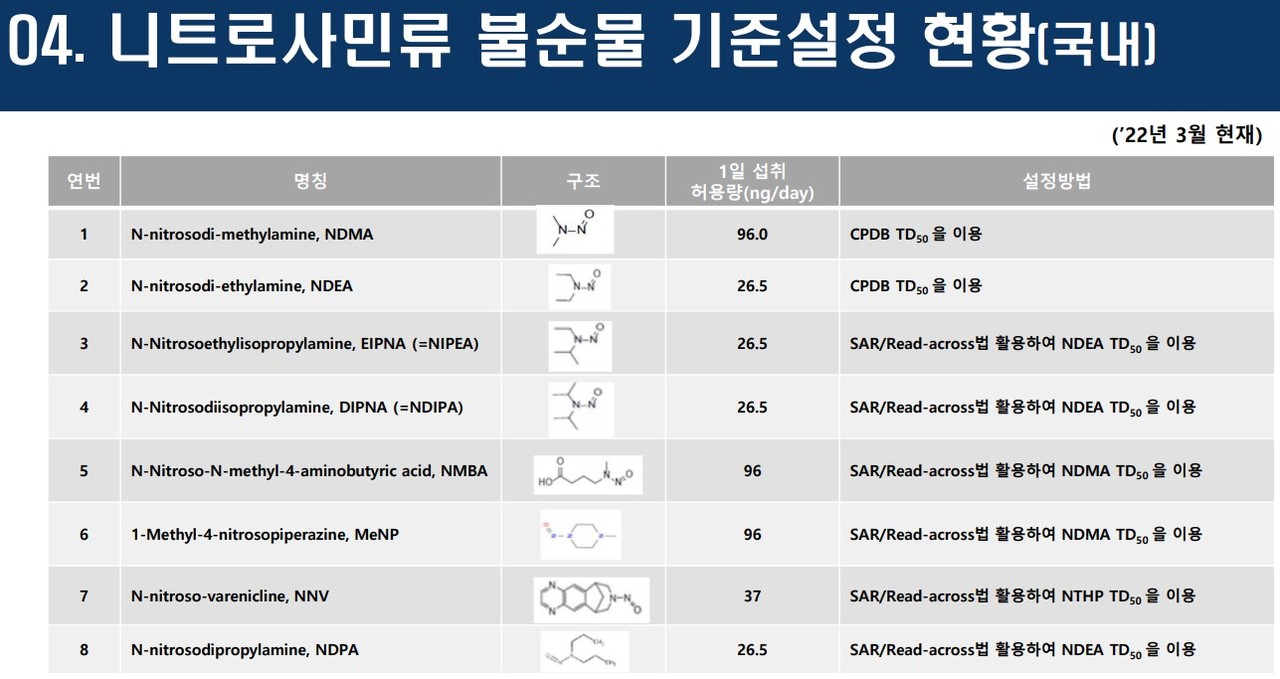
이 마저도 해당하지 않는다면 3단계로 니트로사민류 클래스 특이적 TTC(독성학적 역치)를 활용하게 된다. 식약처와 FDA는 동일하게 기본값(default)을 26.5ng/day로 정했다. 이 기본값에 기초해 니트로사민류 불순물들의 1일 허용 섭취량이 설정되게 된다.
박재현 연구관은 "니트로사민류 불순물의 일일 섭취 용량을 설정함에 있어 불순물 평가 역량 향상이나 실제 신속한 기준 설정을 위한 협력 체계가 필요하다고 생각했다"며 "실제 업계에서 제출한 근거 자료를 검토하기 위한 내외부 전문가 자문 위원회를 꾸렸다"고 밝혔다.
자문위원회는 품질 분야 전문가, 독성 발암성 전문가, Read-across 관련 전문가로 된 약 10인으로 운영 중이다.

박 연구관은 "식약처에서 정기회의와 수시회의를 통해 기준설정과 자문을 기준 설정에 대한 자문을 요청하고 있고, 최종적으로 중앙약사심의위원회를 통해 일일섭취허용량을 정하고 있다"며 "업계에서 발생 가능한 니트로사민류 불순물에 대한 검토를 진행하다가 실제 발생이 관찰될 시, 기준 설정 근거를 제출해 준다면 충분히 사례별로 검토 가능하다"고 말했다.
한편, 발사르탄에서 NDMA 발생이 보고된 이후로 실제 의약품 중 니트로사민류에 대한 불순물 이슈가 지속되자 식약처는 2019년도에 케미컬 의약품 제조업체들을 대상으로 의약품 중 불순물이 발생가능한지를 평가해서 2021년 5월 31일까지 평가자료를, 2022년 5월까지 시험 검사 자료를, 실제 필요한 경우에는 2023년 5월까지 허가 등 변경을 지시한 바 있다.

