불순물 시험검사결과 보고 올해 5월 31일 마감
일부 원료·완제업체 시험검사결과 등 자료제출 기한 연장 요청

과거 NDMA 불순물 문제를 시발점으로 원료·완제의약품 제조업자·수입업자에게 요구됐던 의약품 니트로사민 불순물 시험검사 보고기한이 다시 한번 연장의 기로에 섰다.
국내 원료·완제의약품 제조업자·수입업자(이하 원료·완제업체)는 업체가 제조·수입하는 전체 의약품에 대해 오는 5월 31일까지 식품의약품안전처(처장 김강립)에 NDMA 등 니트로사민 불순물에 대한 시험검사 등을 실시해 보고해야 한다.
다만 히트뉴스가 업계 관계자와 취재한 결과에 따르면, 일부 제약사들이 최근 한국제약바이오협회(회장 원희목) 측에 시험검사결과 등의 자료제출 기한을 연장해 줄 것을 요청하는 의견을 제출한 것으로 확인됐다.
이에 따라 협회는 시험검사 및 허가(신고)·등록사항 변경 등에 대해 국내 원료·완제업체의 준비 현황 및 애로사항 등을 조사해 필요한 조치를 검토할 목적으로 준비현황 및 의견 등을 지난달 28일 공문을 통해 업체에 요청한 것으로 보인다.
요청 대상은 사전에 자사 품목 발생가능성 평가 결과, 니트로사민류 불순물 발생가능성이 있다고 판단된 품목을 보유한 업체인 것으로 파악된다.
한편, 의약품 니트로사민 불순물 시험검사 보고기한이 연장된 것은 이번이 처음이 아니다.
식약처는 최초 2019년 11월 22일 원료·완제업체에 공문을 보내 NDMA 등 불순물에 대한 발생가능성 평가와 시험검사를 자체적으로 실시해 제출할 것을 요청했다. 발생가능성 평가는 2020년 5월 31일, 시험검사는 2021년 5월 31일까지로 해당 결과 등에 따라 원료 등록·허가(신고) 사항 변경을 2022년 5월 31일까지 완료하도록 지시했다.
다만, 원료·완체업체들이 코로나19 팬데믹으로 인한 해외 제조처 업무 중단과 원료·완제의약품 관련 자료의 취득·생성에 큰 어려움을 겪으면서 보고기한 연장을 요청했다. 이에 2020년 4월 29일 식약처는 각 기한을 2020년 12월 31일, 2021년 12월 31일, 2022년 12월 31일로 연장했다.
연장은 여기서 끝이 아니었다. 코로나19 팬데믹이 장기화되면서 식약처보다 앞서 NDMA 조사를 하고 있던 유럽 의약품청(EMA) 측이 업체의 자료제출 기한을 연장하면서, 국내 제약사들이 EMA 제출 자료를 공유받기 힘들어졌다.
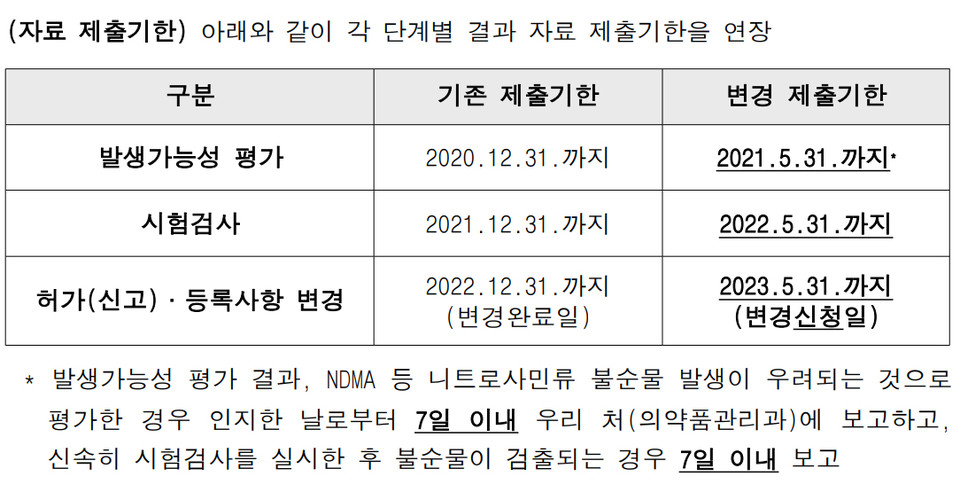
식약처는 EMA의 조치사항 등을 고려해 2020년 12월 14일 국내 원료·완제업체에 니트로사민 불순물 시험검사 보고기한을 5개월씩 연장한 2021년 5월 31일, 2022년 5월 31일, 2023년 5월 31일로 변경한다고 알렸다.
또한 원료 등록·허가(신고) 사항 변경일의 경우, 완료일 기준이 아닌 신청일 기준으로 둬 제약사에 시간적 여유를 부여했다.
현재 보고기한이 한달 가량 남은 상황에서, 자사 품목 시험검사 외에도 해외제조소의 시험 자료들을 추합해 식약처에 제출하기까지 시간이 빠듯할 수 있다는 업계 업계 의견이 있는 가운데, 또 한번 보고기한이 연기될지 주목된다.
관련기사
- 식약처, NDMA 등 불순물 발생가능성 평가 돌입
- NDMA 등 불순물 발생가능 보고, 내년 5월로 연기
- 메트포르민 NDMA 기준 초과 검출… 식약처 조치 촉각
- 식약처, NDMA 등 불순물 발생결과 보고 연장 검토
- EMA, NDMA 조사보고 10월까지 연장...식약처는?
- 니자티딘에서도 NDMA 검출, 회수포함 대응조치 곧 발표
- 복수 니트로사민류 불순물 검출 기준 "발암위해도 10만분의 1로"
- "제네릭 숫자 많은 국내산업 특성 상 불순물 대책 난망"
- 니트로사민 불순물 시험결과 제출 임박... 이럴 땐 연장요청 가능
- 니트로사민 불순물... 발생가능성 변경시 수탁사 자료도 OK
- 빈번한 의약품 불순물... 식약처, 안전관리 가이드라인 마련

