이재현 성균관대 교수의 '스페셜 정책 리포트'

[상] 미국의 의약품 일련번호 및 공급내역 보고
[하] 한국과 미국 일련번호 제도 비교 및 시사점
지난 10월 10일부터 12일까지 미국의 수도 워싱턴에서 2018년도 'IFPW(국제의약품유통업체연맹
) 정기총회'가 열렸다. 우리나라를 비롯한 전 세계 20여개 국에서 의약품 유통 분야의 협회 및 단체, 그리고 기업 관계자 등 전문가 200여명이 참가하여 세계 의약품 유통시장의 트렌드와 문제점을 공유했다. 본인은 한국의약품유통협회 IFPW 참가자의 일원으로써, 동 기간 중에 의약품 일련번호 제도(serialization)와 관련하여 IFPW 회장단 및 일본의 유통업계 관계자와 의견을 교환하는 자리를 가졌다. 이를 계기로 제약 선진국인 미국에서 시행 중인 의약품 일련번호 제도의 추진 과정을 살펴보고 우리나라와의 비교를 통해 시사점을 찾아보고자 한다.
참고로 일본에서는 2006년 9월 후생노동성에서 전문의약품에 대한 유통코드(의약품고유코드, 사용기한 및 제조번호로 구성)를 정하고, 2020년까지 포장단위마다 이를 표시하도록 의무화했는데, 동 조치를 통해 유통과정에서 의약품을 보다 효과적으로 추적할 수 있는 획기적인 진전을 이룰 것이라고 설명하고 있다(출처: JPWA Guidebook 2018~2019, 일본의약품유통업체연맹). 일본은 현재 우리나라가 일련번호 제도를 시행하기 이전에 사용했던 GS1 국제표준코드체계 중 GTIN-13을 사용 중에 있으며, 아직 일련번호 제도를 도입하려는 구체적인 움직임은 없는 것으로 확인되었다.
의약품은 제조, 유통 및 판매의 각 단계마다 여러 가지의 규제 장치를 두어 엄격하게 관리하고 있음에도 불구하고, 시장의 특성상 여러 단계를 거치기 때문에 유통과정에서 위·변조 의약품과 불법 의약품이 꾸준하게 증가하고 있어 전 세계에 위협이 되고 있다. WHO 및 APEC 등 다양한 국제기구에서는 환자 보호를 위해 의약품의 'supply chain(주: 의약품 제조업자, 수입자, 도매업자, 유통업자 및 소매업자 등으로 구성된 의약품 유통과정을 포괄하는 용어로 쓰인다. 이하 "유통망"이라고 표현한다)' 안에 취약점이 어디인지, 어디에서 부정이 일어날 수 있는지를 찾아 이를 예방하고, 또한 이러한 문제들에 관한 정보를 공유하여 협력을 통해 문제 해결 방안을 모색하고 있다.
최근 AHC(APEC Harmonization Center)에서는 국제 조화(Harmonization)를 위해 의약품 등 의료제품 유통체계 9개 분야에 대한 국제 우수 사례와 가이던스 문서를 포함하는 교육용 툴킷(Tool-kit)을 발표했다. '어떤 목적을 이루기 위한 도구들'로 해석되는 이 툴킷에서는 의약품 유통망에서 제품을 추적하기 위한 수단으로 유통정보의 식별(Identify), 수집(Capture) 및 공유(Share)를 제시하고, 그중에서도 정보의 공유를 강조하고 있다. 유통정보는 제품식별자, 사용기한, 제조번호 및 일련번호로 구성되고, 수집 방법으로 선형 바코드, 2D 바코드 및 RFID tag가 있으며, 세계적으로 바코드가 가장 많이 채택되고 있다고 설명하고 있다. 공유해야 하는 정보에는 의약품 자체에 대한 것, 거래에 대한 것과 이동 경로에 대한 것들이 있으며, 정보의 공유는 유통망 내의 당사자들과 관계기관들 사이에서 이루어지고, 최종적으로 의사와 약사까지 추적 시스템에 포함되어 입고 과정에서 정확한 의약품이 환자에게 처방되는지 확인하는 것이 불법 의약품 차단을 위해 중요하다는 점을 지적했다. 이와 같은 국제 조화를 통해 불법 의약품 및 위·변조 의약품의 유통을 막아 안전성을 확보하고, Recall 절차의 진행, 사용기한 만료 제품의 재판매 방지, 공급 부족의 예방, 품질정보의 확보, 정책 수립과 약물감시 및 전략적 기획에 도움, 유통비용 10% 절감 효과를 줄 것으로 보고 있다.
지난 몇 년 동안 의약품 유통 전반에 걸친 문제가 대두됨에 따라 의약품 유통망에서 일련번호의 부착과 추적 시스템의 구현은 위·변조 의약품과 불법 의약품을 막기 위한 효율적인 도구로 여러 국가의 규제 당국에 의해 인정되어왔다. 세계적으로 일련번호 및 추적 시스템을 이행 중이거나 이행 단계에 있는 국가들이 있는 반면, 다양한 대안을 평가하고 있거나 아직 시행할 예정이 없는 국가들도 있다. 대표적으로 우리나라와 미국, 중국, 인도, EU, 브라질, 아르헨티나, 터키에서 의약품 일련번호 부착과 추적 시스템을 제도화하거나 시행 중에 있다. 국제표준화기구인 GS1은 국제적인 정보표준화에 70여개 국가가 참여하고 있다고 밝혔다.
이에 미국의 의약품 일련번호 및 공급내역 보고 제도 도입과 시행 과정을 살펴보고 이를 우리나라와 비교함으로써 시사점은 무엇인지 정리하고자 한다.
1. 미국의 의약품 일련번호 및 공급내역 보고 제도
□ 의약품 일련번호 보고 제도의 도입
미국의 의약품 일련번호 제도는 의약품의 최소 판매단위에 고유번호인 일련번호를 부착하여 제조, 수입, 유통 및 사용 등 모든 단계에서 각각의 이력(Pedigree)에 대한 추적관리가 가능하도록 하는 제도이다.
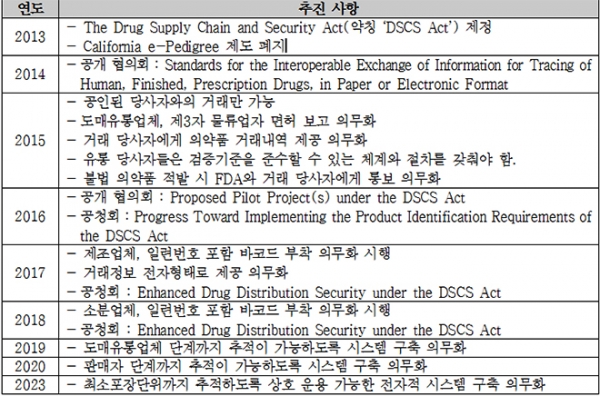
미국에서는 1988년 'Prescription Drug Marketing Act'가 제정된 이래로 의약품의 이력관리에 관한 법률이 존재해왔으나, 2013년 'The Drug Quality and Security Act'가 제정될 때까지 유명무실한 상태에 머물렀다. 2000년대 미국에서는 몇 차례에 걸쳐 위조 의약품 사례가 있었고, 규제 당국은 이 위조 의약품들이 일련의 유통업체들을 통해 유입되었다는 사실을 발표했다(주: 2010년에 용량의 3배 이상 전문약 성분(sibutramine)이 포함된 비만치료제 '알리(Alli)' 위조약 사건, 2012년에 활성성분이 전혀 함유되어 있지 않은 고가 항암제인 '아바스틴(Avastin)' 위조약 사건이 발생했다-약물역학위해관리학회지 2013;6:79-86). 이후 실제로 더 많은 가짜 약이 미국에서 발견되었으며, ‘FDA Counterfeit Drug Task Force’는 의약품 유통 시스템의 허점에 대한 보고서를 발표했다.
한편 2012년에 'New England Compounding Center'가 스테로이드제제의 혼합 과정에서 멸균상태를 유지하는데 실패, 오염된 조건에서의 Compounding(주 : 개별 환자에 맞게 특정 의약품을 만드는 것 -Wikipedia)으로 인해 진균성 수막염이 발생하여 64명이 사망하고 750명이 감염되는 사건이 발생했다. 이에 미국 의회는 2013년에 기존의 규제 사각지대에 있던 Compounding 문제와 의약품의 유통과정을 추적하기 위한 규제를 결합한 'The Drug Quality and Security Act'를 제정했다. 동 법률은 Title l. 'Compounding Quality Act'와 Title ll. 'The Drug Supply Chain and Security Act'(이하 ‘DSCS Act’)로 구성되어 있는데, 일련번호와 공급내역 보고에 관한 부분은 Title ll.이다.
DSCS Act는 당시 플로리다와 캘리포니아 주(州) 정부 차원의 의약품 이력관리 제도를 대체하고, 특히 불합리한 정부 규제로 인식되던 캘리포니아의 RFID tag 부착을 주요 내용으로 하는 'e-Pedigree' 제도를 무력화시켰다. DSCS Act는 의약품 공급자와 판매자에 대한 규제의 불일치 문제를 해결하고, 미국인을 부정·불량 의약품 및 위·변조 의약품으로부터 보호하며, '회색 시장(주 : gray market-암시장(black market)과 정상적인 보통 시장의 중간적 시장)'으로 인한 의약품 가격 상승을 막고 효율적인 재고관리를 통해 의약품의 부족 상황을 해결하는 것을 목적으로 하고 있다.
![[그림] 미국 의약품의 흐름 (출처 : THE PEW CHARITABLE TRUSTS, 2014)](https://cdn.hitnews.co.kr/news/photo/201810/3814_3188_034.jpg)
□ 의약품 일련번호 보고 제도의 개요
미국의 의약품 일련번호 제도는 공인된 당사자와의 거래를 전제로, ‘의약품에 일련번호를 부착하는 단계(Product Identification)’, ‘일련번호 등의 정보를 확인하는 단계(Verification, Capture)’ 그리고 ‘관련 제품 정보를 제공하는 단계(Product tracing, Share)’로 나눠진다. 미국의 유통 관련 이해 당사자(Stake holders)에는 ‘제조업자와 수입업자를 통칭하는 제조업체(Manufacturer)와 재포장 업무를 수행하는 소분업체(Repackager) 및 도매유통업체(Wholesale Distributor)’(이하 ‘의약품 공급자’라고 칭한다) 그리고 FedEx, DHL과 같은 제3자 물류업자(Third-party Logistics, 3PL)와 ‘주로 약국에 해당하는 조제자(Dispenser)’(이하 ‘의약품 판매자’라고 칭한다)가 있다.
의약품 일련번호의 구성
'의약품에 일련번호를 부착하는 단계'로써 의약품을 공급하는 모든 제조업체 및 소분업체들은 완제의약품 형태의 처방의약품에 대해 최소 판매단위 마다 일련번호를 부여하는 것이 의무화되었다. 제조업체는 2017년 11월 27일까지, 소분업체는 2018년 11월 27일까지 일련번호를 포함한 제품식별자를 부착해야 한다.
일련번호는 의약품 표준코드별로 고유번호를 부여하고, 2D 바코드(2D data matrix)를 부착한다. 2D 바코드는 GS1 국제표준코드체계(GS1-128)에 따르며, 고유식별자는 국가의약품코드(NDC, National Drug Code), 일련번호를 포함한 표준화된 번호식별자(SNI, Standardized Numerical Identifier), 제조번호, 사용기한으로 구성되어 있다.
의약품 Track and Trace
'일련번호 등의 정보를 확인하는 단계'로써 2015년 1월 1일부터 의약품 공급자가 의약품 거래정보를 다음 거래 당사자에게 해당 제품의 출하 전이나 출하 시점에 교환하는 'Track and Trace' 방식이 도입되었다. 의약품 판매자는 문제가 있다고 의심이 가는 의약품이나 회수 대상 의약품 외에 다른 요양기관에 의약품을 배송하거나 환자에게 의약품을 조제하는 경우에는 의약품 거래정보를 제공하지 않아도 된다. 제공하는 정보에는 거래에 대한 이력(Transaction History, TH), 제품명·국가의약품번호·물량·제조번호·거래일자 등 거래 제품에 대한 정보(Transaction Information, TI) 및 소유권 이전에 따른 거래명세(Transaction Statement, TS)로 구분하고, 해당 정보는 전자 형식으로 제공하며 6년간 보관한다.

'관련 제품 정보를 제공하는 단계'에서는 FDA의 요청이 있거나 의심이 가는 제품 혹은 불법 의약품이 있는 경우 24시간 이내에 거래 당사자와 FDA에 해당 의약품의 정보를 제공해야 한다. 이러한 의약품 공급정보를 제공하기 위해 각 이해 당사자는 상호 운용 가능한 전자시스템을 갖출 것을 의무화했다. 또한, 유통 당사자들은 검증기준에 부합하는 체계와 절차를 갖춰야 한다. 의심이 가는 의약품에 대한 당국의 요청에 응답하며, 해당 제품을 격리하고 조사하여 불법 제품을 판별해야 한다. 격리된 의약품은 점검표를 통해 포장이 손상되었거나 받은 제품이 송장과 맞지 않은 경우에는 명백하게 결함이 있는 제품으로 분류하고, 바코드가 스캔되지 않는 경우에도 대상이 된다. 전자의 경우 교환을 위해 유통업체와 연락하고, 그중에서도 의심이 가는 제품에 대해서는 규제 당국에 알려야 한다. 후자의 경우에도 FDA의 허가를 받은 국가의약품번호가 아니라면 규제 당국에 알려야 한다.
Aggregation
미국의 의약품 포장단위는 Package/Unit level, Single pack level, Multi-pack/ Bundle level, Pallet/Case/Box level로 나뉜다. 의약품 유통망에서 묶음번호관리는 개별 최소 판매단위 제품에 표준화된 번호식별자를 확인하고, case 및 pallet level 포장단위에 묶음번호를 부여하여 할당된 제품식별자 간의 관계를 구축하는 과정인 Aggregation과 모든 품목이 해당 level 포장단위에 속하는지와 더 높은 수준의 포장 내용물에 대한 정보를 조사하고 누락되거나 잘못 포장된 의약품이 있는지를 추론하는 Inference로 구분된다.
그동안 미국은 수차례의 공청회 및 협의회를 통해 Aggregation과 Inference 의무화에 대해 지속적으로 논의하고 있으며, DSCS Act 시범사업을 기반으로 이해 당사자들과 협력하여 Aggregation에 대한 검토 및 평가를 진행하고 있다. Aggregation은 DSCS Act에 의무화된 것은 아니지만 많은 거래 당사자가 필요로 하며 업계의 표준이 되어가고 있다. 또한 DSCS Act 도입 후 10년 뒤인 2023년에는 의약품 유통 보안을 강화하기 위해 필요에 따라 Aggregation과 Inference를 포함할 수 있다고 명시하고 있다.
□ 제도 추진 과정
2013년 9월 27일 DSCS Act가 도입되면서 불필요한 규제를 없애고자 캘리포니아에서만 적용되던 e-Pedigree 법을 폐지했다. 이로 인해 RFID tag를 사용하던 캘리포니아도 DSCS Act가 적용되었다.
이후 2023년까지의 10년간에 걸친 정책 시행 road-map에 따라 2015년부터 DSCS Act에 의거 주(州) 또는 연방 면허를 받은 유통업체 및 제3자 물류업자 등 공인된 유통 당사자와의 거래만 가능하며, 거래 당사자에게는 거래 내역을 의무적으로 제공하게 되었다. 또한 이해 당사자들은 검증기준을 준수할 수 있는 체계와 절차를 갖추고, 불법 의약품이라고 판명될 경우에는 FDA와 거래 당사자에게 통보하도록 했다.
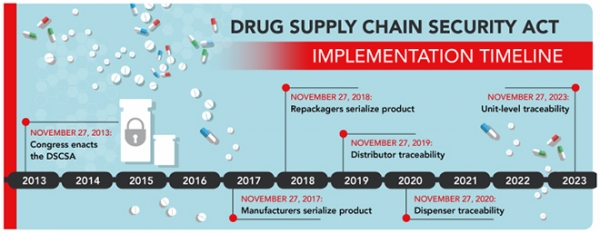
아울러 2017년 이전에 의약품 제조업체 및 소분업체는 제품식별자에 국가의약품번호만 표기했으나, 2017년부터 제조업체, 2018년부터 소분업체를 대상으로 일련번호를 포함한 2D 바코드를 부착하고, 해당 거래 정보를 전자 형태로 제공하도록 의무화되었다.
향후 2019년부터는 도매유통업체 단계까지, 2020년부터는 의약품 판매자 단계까지 제품 추적이 가능하도록 시스템을 구축하는 것이 의무화될 예정이며, 2023년에는 의약품 최소포장단위(package-level)까지 추적이 가능하도록 상호 운용 가능한 전자적 시스템 구축이 의무화될 예정이다.
[하편은 11월 2일 금요일 계속]

