식약처, 원료ㆍ완제사에 자료제출ㆍ안전조치 요구
NDPA 불순물 문제로 시험검사결과 제출 지시는 처음
지난해 미국식품의약국(FDA)이 신경정신과 부작용 경고 최고 단계로 격상하며 한 차례 이슈가 됐던 몬테루카스트 제제가 이번에는 불순물 함유 가능성 때문에 관련 원료 및 완제 제약회사들이 촉각을 곤두세우고 있다.
최근 식품의약품안전처(처장 김강립)는 천식과 알레르기 비염 치료에 사용되는 '몬테루카스트나트륨' 원료의약품에서 '니트로사민 불순물 중 하나인 NDPA(N-니트로소디프로필아민, N-Nitrosodipropylamine)가 검출됐다는 안전성 정보를 인지, 해당 제제 원료·완제 제조·수입자 대상으로 NDPA 자료제출 및 안전조치 등을 지시했다.
NDPA 불순물 검출 문제로는 처음으로 시험검사 결과를 업체들에게 요구한 식약처는 "몬테루카스트나트륨 성분 원료의약품에서 니트로사민 불순물 NDPA가 검출됐다는 안전성 정보 인지에 따라 사전예방적 조치로 제조(수입)하는 몬테루카스트 성분 원료(완제)의약품에 대해 약사법령에 따라 조치를 지시한다"는 내용의 공문을 발송했다.
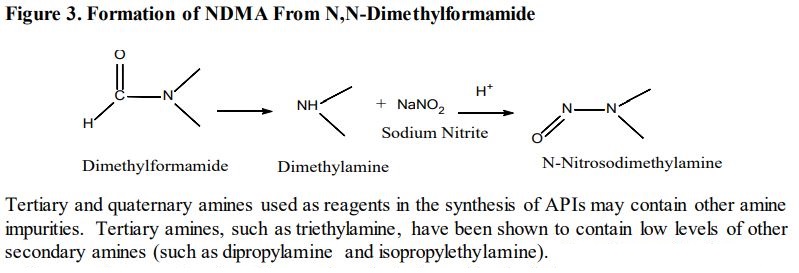
미국 FDA가 발행한 산업계 가이던스인 '인간 대상 의약품의 니트로사민 불순물 관리(Control of Nitrosamine Impurities in Human Drugs)'에 따르면, NDPA는 원료의약품 합성 과정에서 형성될 수 있다.
API 합성(원료의약품 합성) 과정에서 시약으로 사용되는 3차 아민의 탈알킬화(알킬 작용기가 떨어져 나감)가 일어나 2차 아민인 DPA(디프로필아민)를 형성할 수 있다는 것이다. 이 DPA가 니트로소 화합물에 존재할 경우 NDPA라고 명명한다.
식약처의 요청에 따라 원료 제조·수입자는 시중 유통 가능한 대표성 있는 제조번호(연단위 3개 로트 이상)에 대한 시험 검사 결과를 오는 4월 25일까지 제출하고, 검사 결과에 따라 필요 시 추가 후속조치를 진행해야 한다.
또 완제 제조·수입자는 완제의약품 제조 공정에 대한 불순물 발생가능성 평가를 실시하고 해당결과를 오는 4월 25일까지 제출하고, 필요한 경우 원료 제조·수입자와 동일하게 시험검사 및 추가 후속 조치를 진행해야 한다.
제출기한 이전이라도 해당 불순물(NDPA)이 검출된 경우 즉시 식약처 의약품관리과에 보고하는 등 필요한 조치를 취해야 한다.
시험 검사는 △국내 의약품(GMP 제조업자·수입자의 실험실(자사 또는 타사 연구소포함) △식약처 지정 품질검사기관 △한국의약품수출입협회 등에서 가능하며, 해외제조원의 시험 결과(시험성적서)를 인정한다.
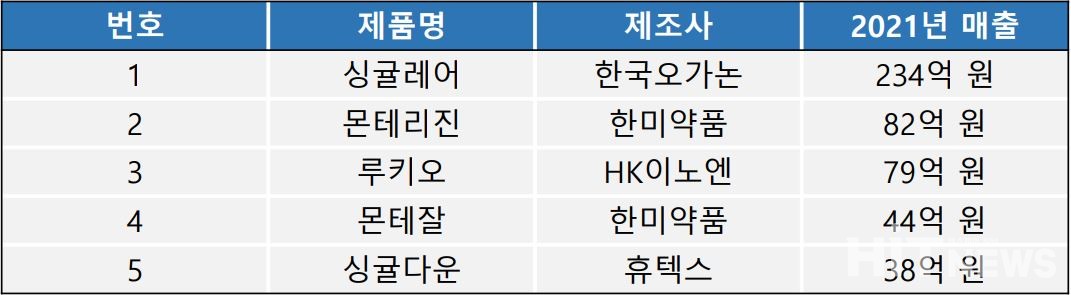
시장조사기관 유비스트에 따르면, 국내 몬테루카스트 제제 시장 규모는 2021년 기준 883억을 기록했다. 현재 식약처 품목허가를 가진 제약사는 119개 업체며, 329개 품목이 존재한다.
가장 많은 처방액을 기록한 제품은 오리지널인 한국오가논 '싱귤레어'로, 지난해 234억 원의 원외처방액을 올렸다. 2위는 몬테루카스트나트륨과 레보세티리진염산염 복합제인 한미약품 '몬테리진', HK이노엔이 루키오가 그 뒤를 이었다.

