김주상 씨 'FDA GMP 실사 분석 의약품 품질관리 실태조사 연구'
OAI에는 워닝 레터 발급
식약처 GMP실사 정보공개하면 국내사 해외진출에 도움

미국 FDA GMP 실사 시, 국내 제약사는 일본 제약사에 비해 '작업원의 자격', '안정성시험'이 각각 3.13배, 2.2배 높은 지적사항 발생비중을 보였으며, 미국 제약사에 비해 '자동, 기계, 전자식 설비', '실험일반사항', '실험기록관리' 부분에서 각각 1.6배, 1.43배, 1.83배 높은 지적사항을 받았다는 연구 결과가 나왔다.
현재까지 미국 FDA에 품목허가를 받은 국내 제약사 의약품은 총 25제품에 달한다. GC녹십자 'GC5107', 휴젤 '레티보' 등 다양한 국내 제약사들이 현재 FDA 품목허가 절차를 진행하고 있거나, 진행 예정이다. 이 과정에서 국내 제조시설에 대한 FDA GMP 실사는 제약사가 거쳐야 할 필수 관문이다.
지난해 12월 전북대학교에서 개최된 '2021 대한약학회 추계학술대회'에서는 국내 제약사의 FDA GMP 실사와 관련돼 'FDA GMP 실사 지적사항 분석을 통한 의약품 품질관리 실태조사 연구 – 한국, 일본, 미국 중심으로'(김주상, 2022. 02. 성균관대학교 약학대학 제약산업학과 석사논문, 지도교수 이재현) 논문 포스터가 소개됐다.
논문의 저자인 김주상 씨는 "세계 의약품 시장의 40%를 차지하고 있는 미국 의약품 시장에 진출하기 위해 여러 국가에서 다방면으로 노력하고 있는 상황"이라며 "FDA 실사가 의약품 수출에 필수적으로 거쳐야 하는 관문임에도 불구하고 FDA 실사 지적사항에 대한 분석을 CFR(미국연방규정, Code of Federal Regulations) 세부 섹션으로 구분해 분석한 연구는 부족하다"고 설명했다.
이에 따라, 저자는 한국·일본·미국의 FDA GMP 실사 지적사항을 분석하여 한국의 의약품 품질관리 실태조사 연구를 진행했다. 또한, 이 연구 결과를 통해 FDA GMP 실사 트렌드를 파악하고 의약품 품질관리 측면에서 보완점을 제시해 향후 FDA 실사를 준비하는 제약사가 참고할 수 있도록 하기 위한 목적이라는 점을 밝혔다.
연구 범위는 2009년부터 2020년까지 FDA Data dash board의 실사 자료 중 한국·일본·미국의 GMP 실사 데이터 및 지적사항으로 한정됐다.
한국, 미·일 제약사에 비해 GMP 실사 OAI 등급 비율 3~7배 높아
미국 FDA GMP 실사 결과, Warning letter가 발급되는 OAI(Official Action Ispection) 등급 비율은 국내 제약사가 24.48%로 미국(7.91%), 일본(3.85%)보다 높았으며, 추가 조치가 필요 없는 NAI(No Action Inspection) 등급 비율은 13.63%로 미국(44.27%), 일본(28.84%)보다 낮았다.
연구 포스터에 따르면, 미국 FDA GMP 실사 결과 Warning letter가 발급되는 OAI(Official Action Ispection) 등급 비율은 국내 제약사가 24.48%로 미국(7.91%), 일본(3.85%)보다 높았으며, 추가 조치가 필요 없는 NAI(No Action Inspection) 등급 비율은 13.63%로 미국(44.27%), 일본(28.84%)보다 낮았다.
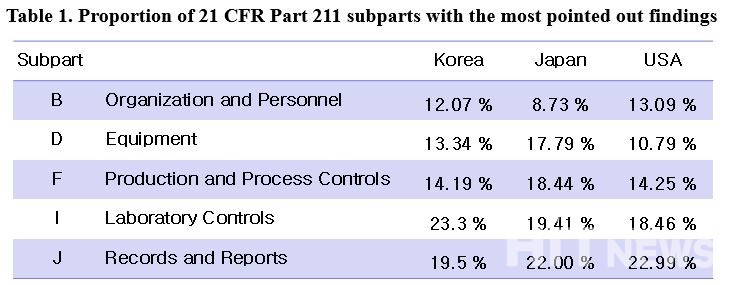
이 실사 결과를 미국의 cGMP 규정인 CFR Part 211 내 Subparts별로 분류한 결과, 가장 많이 지적된 소견은 Subpart △B(Orginization and Personnel) △D(Equipment) △F(Production and Process Controls) △I(Laboratory Controls) △J(Records and Reports)에서 발생했다.
국내 제약사,
일본 업체 비해 '작업원 자격', '안정성시험' 지적 비중 커
미국과는 '자동, 기계, 전자식 설비', '실험일반사항' 등에서 차이
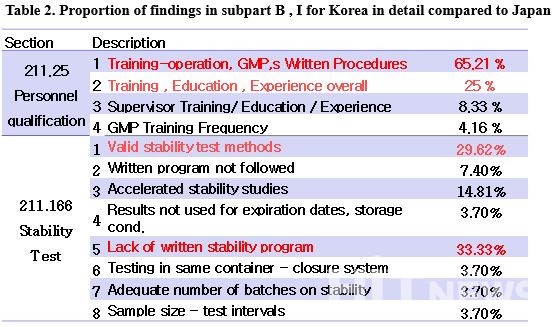
한국은 일본 대비 '작업원의 자격' 3.13배, '안정성시험'에서 2.2배 높은 지적사항 발생비중을 보였다. 저자는 세부 원인으로 △작업원에 대한 교육 미흡 △안정성시험프로그램 부재 △적절하지 않은 시험법 사용 등을 꼽았다.
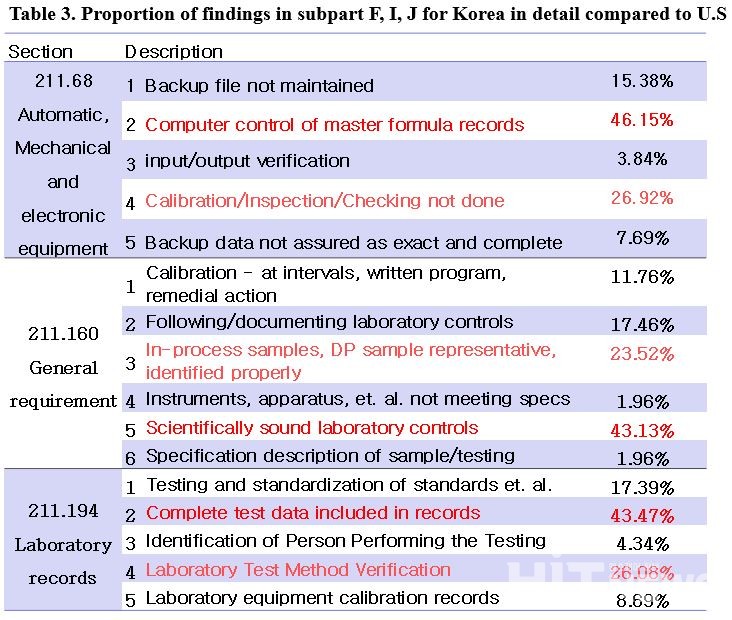
한국은 미국 대비 '자동, 기계, 전자식 설비' 1.6배, '실험일반사항' 1.43배, '실험기록관리' 부분에서 1.83배 높은 지적사항 발생비중을 보였다. 저자는 △Data Integrity(데이터 무결성) 중 실험실기록관리 △기기의 권한관리(Provisioning) △실험실 관리 등 부분에서 개선이 필요할 것이라고 분석했다.
김주상씨는 "본 연구는 발표된 FDA GMP 결과만을 가지고 분석했으며, 의약품의 제형에 대한 분석 결과 등 상세한 분석을 진행하지 못한 한계가 있다"며 "식품의약품안전처에서도 미국 FDA 같이 GMP 실사 정보를 공개할 수 있는 데이터베이스를 구축한다면 기업의 해외 진출에 큰 도움이 될 것"이라고 제안했다.

