물질발굴, 임상개발, 상용화까지 경험하는 동반자형 파트너십
**암 학회에서 열공했던 박PD의 '촉'
4월 AACR를 시작으로 6월 ASCO, 9월 ESMO, 11월 SITC까지 주요 암 학회에 참여하였다. 회사에서 신약 개발을 하는 것도 아니고 학교에서 관련 연구를 하는 것도 아니며 의료인은 더더욱 아닌 사람이 왜 참여했을까? 외관상 참여할 이유가 별로 없어 보이지만, 열심히 참여하여 공부했던 이유는 단 하나였다. 종양학과 관련된 연구, 개발 동향을 파악하고 싶었기 때문이다.
물론 위에서 언급한 학회가 열리면, 국내외 다양한 매체들이 관련 소식을 전하고 이들을 충실히 살펴보는 것으로도 큰 도움이 된다. 하지만, 여러 포스터들을 하나씩 살펴보면서 나름의 기준으로 분류하고 꼼꼼히 정리하면 그 이상을 배울 수 있다.
AACR, ASCO, ESMO, SITC와 같은 암 학회는 학계에서 주관하는 것이지만, 산업계와 시장의 관심이 매우 높다. 잘 진행되고 있는 연구의 구체적인 결과를 확인할 수 있을 뿐만 아니라, 기대에 미치지 못한 연구들도 살펴볼 수 있다. 성공적인 연구를 보는 것도 중요하지만, 이보다 더 중요한 것은 잠정적으로 실패한 연구를 살펴보는 것이 아닐까 싶다. 우리에게는 성공 사례를 보고 따라하는 것보다는 실패 사례를 통해 혁신을 모색하는 것이 더욱 필요하기 때문이다.
면역항암제에 대한 세간의 관심은 점점 높아지고 있고 SITC에 발표된 1,000여개의 포스터를 통해서도 그 열기를 확인할 수 있었다. 지난 ESMO 때 다이이찌산쿄의 엔허투가 보여준 것처럼 드라마틱한 결과는 없었지만, 미래가 기대되는 연구는 분명히 있었다.
현재까지 시장에서 가장 성공한 면역항암제는 키트루다, 옵디보를 포함한 다수의 항PD-(L)1 항체 약물이다. 이러한 약물은 림프구(T세포)에 존재하는 특정 관문(checkpoint)를 타깃하여 T세포의 정상화, 활성화를 유도한다. 문제는 항PD-(L)1 항체에 처음부터 반응하지 않는 환자가 있고 반응하더라도 이내 내성이 발생하는 환자도 상당수 있다. 면역항암제 관련 수많은 포스터의 첫 단락이 위와 같은 문장으로 시작하는 것과 키트루다 등과 새로운 면역관문억제제와의 수많은 병용요법은 이를 방증한다.
림프구(lymphoid cell)와 관련된 면역관문 중 가장 활발하게 개발하고 있는 타깃은 단연 TIGIT(T cell immunoreceptor with Ig and ITIM domains)일 것이다. 로슈의 티라골루맙(tiragolumab)은 아테졸리주맙(판매명: 티센트릭) 병용요법으로 1L 비소세포폐암에서 유망한 데이터를 도출했고 이에 많은 후발 주자들은 고무되었다.

물론 항TIGIT항체도 명확한 한계가 있다. 단일요법 효능은 거의 없고 다양한 암종보다는 일부 암종, 주로 비소세포폐암에서 의미 있는 혜택이 목격되었다. 더불어 비소세포폐암 안에서도 기존 항PD-(L)1항체 이후 재발/불응한 환자에서는 유의미한 혜택을 주지 못했다. 따라서 상당수의 항TIGIT항체 개발은 1L 비소세포폐암에 집중된 편이고 현 시점, 미충족 의료 수요에 완전히 부합하는 것은 아니다.
상황이 이렇다 보니, 항TIGIT항체의 병용요법 파트너로 항PD-(L)1이 아닌, 다른 타깃들도 고려하게 되었다. 다른 면역관문에 비해 TIGIT과 직, 간접적으로 관련 있는 활성/억제 경로는 잘 알려져 있다. 이와 관련하여 항CD96항체, 항PVRIG항체도 병용요법의 파트너로 고려되고 있고 몇몇 회사에서 임상 연구를 하고 있다. 하지만 지금까지는 의미 있는 데이터를 도출하지 못했다.
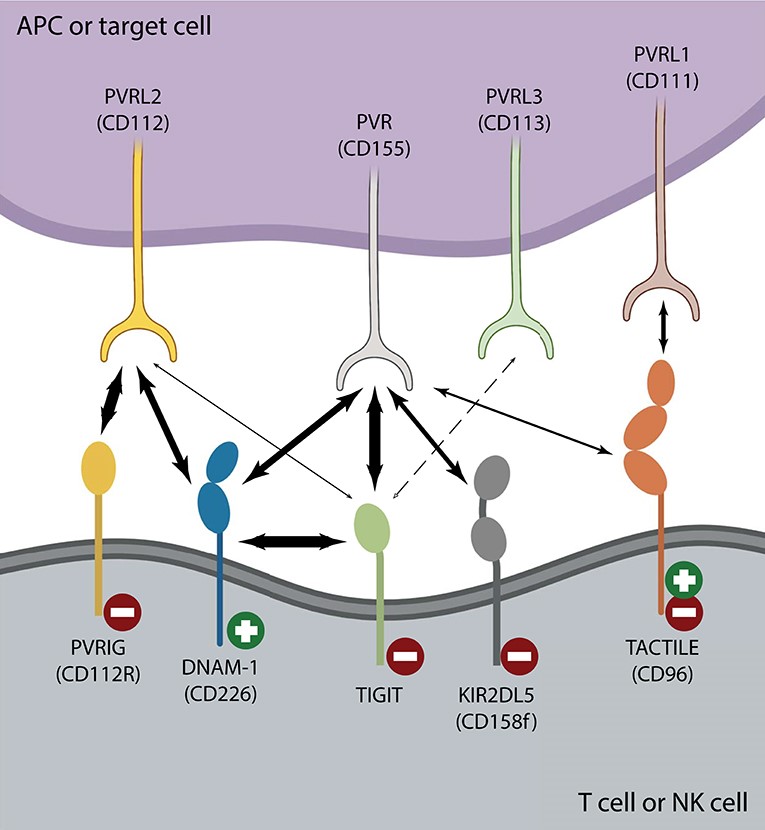
얼마 전 길리어드(Gilead)와 아커스(Arcus bio)의 거래가 있었다. 정확히 말하면, 작년 5월에 옵션 딜이 있었고 최근 길리어드가 타깃 3개(CD73, A2AR/A2BR, TIGIT), 물질 4개(항TIGIT항체 2개)에 대한 옵션을 행사했다. 로슈(Roche), 머크(Merck), BMS, GSK 뿐만 아니라, 다양한 글로벌 바이오텍이 항TIGIT 개발에 뛰어든 상황에서 길리어드가 아커스의 항TIGIT를 선택한 이유는 무엇일까?
아커스의 항TIGIT항체 포트폴리오에는 wild type Fc 버전과 Fc silent 버전이 모두 있고 양자의 차이는 항체의 Fc 영역을 매개한 effector function 유무에 있다. 이러한 점도 고려 요소였겠지만, 좀 더 의미 있는 것은 개발 전략이 아니었을까 싶다. 다수의 회사들이 항PD-(L)1항체+항TIGIT항체 병용요법으로 1L 비소세포폐암 임상을 하고 있는 상황에서 이들과 다른 개발 전략을 갖고 있고 의미 있는 데이터를 기대할 수 있는 합리적인 근거가 있다면, 매력적일 수 있기 때문이다.
아커스는 1L 비소세포폐암 환자를 대상으로 자체 개발한 항PD-1항체, 항TIGIT항체, A2AR/A2BR 길항제(antagonist) 삼중요법으로 임상 2상 중이다. 지난 3분기 어닝콜에서 구체적인 수치를 공개하진 않았지만, 상당수준의 질병 통제력이 있다고 발표했었다(무진행생존기간 중앙값을 포함한 구체적인 데이터는 내년 학회에서 발표할 계획). 이런 점을 고려하면, 아커스의 개발 전략과 속도는 매력적이었을 것 같다(어닝콜 Q&A에 따르면, 길리어드가 해당 임상의 중간 결과를 확인한 것은 아니라고 함).
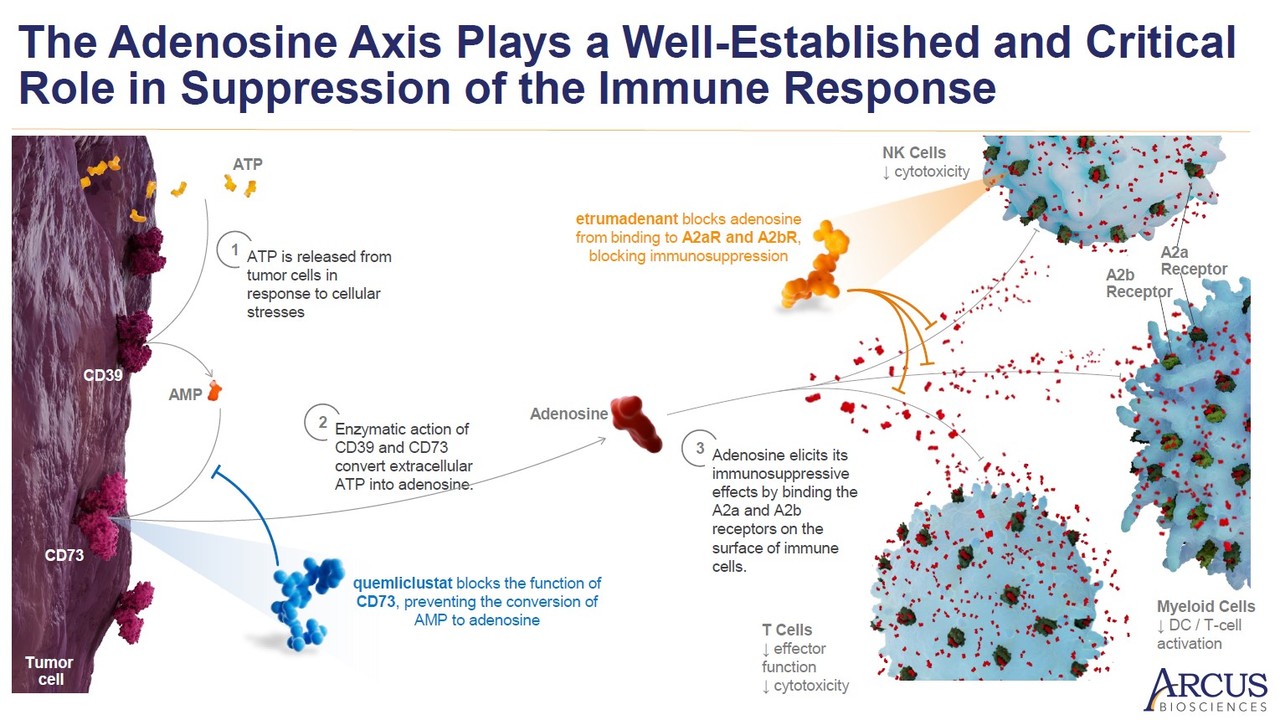
그렇다면, 1L 비소세포폐암 임상 연구에 포함된 A2AR/A2BR 길항제는 어떤 역할을 하기 때문에 항PD-1항체, 항TIGIT 항체와 시너지를 기대할 수 있을까? 이것을 이해하려면, 아데노신 축에 대한 이해가 필요하다. 통상 종양 세포는 세포 외에서 높은 수준의 ATP를 방출한다. 세포 내 ATP는 세포 대사에 필요하지만, 세포 외 ATP는 여러 고형암에서 과발현되는 엑토뉴클레오티다제(ectonucleotidase)인 CD39, CD73에 의해 아데노신(adenosine)으로 전환된다.
이렇게 전환된 아데노신은 T세포, NK세포와 같은 림프구 뿐만 아니라, 여러 골수 세포 표면에 발현되는 A2A수용체 혹은 A2B수용체와 결합하여 면역 억제를 야기한다. 따라서 많은 회사들은 CD39, CD73, A2AR 타깃 약물을 개발하여 종양미세환경의 면억 억제 상황을 개선하고자 했다. 종양미세환경 내 아데노신이 여러 면역 세포에 결합하는 것을 막으면 시너지가 있을 것인지, 내년에 발표될 데이터를 지켜봐야 할 것이다.
작년부터 길리어드는 다양한 경로를 통해 항암 파이프라인을 강화했고 그 포문을 연 것은 포티세븐(Forty Seven) 인수였다. 사명을 통해서도 알 수 있듯이 항CD47항체를 개발하는 회사였다. CD47/SIRPa 축은 최근 각광받고 있는 골수세포 관련 면역관문이다.
관련기사 키트루다·옵디보 이후 면역항암제 어디까지 왔나
길리어드가 확보한 물질 중에는 피오니르(Pionyr)의 TREM1, TREM2 타깃 약물도 있다. 이 타깃은 종양미세환경 내 종양 연관 대식세포(TAM)에 다수 발현되는 것으로 알려져 있고 이러한 면역 관문을 타깃한다면, 대식세포를 포함한 골수세포의 정상화, 리모델링을 유도할 것으로 기대하고 있다. 길리어드가 골수세포의 면역 억제 환경을 개선하는 것에 깊은 관심이 있다는 것을 알 수 있다.
더불어 자운스(Jounce)에서 도입한 항CCR8항체는 종양 침윤 조절 T세포(TITR)를 선택적으로 제거하는 기전이다. 항체 약물이 TITR 세포에 풍부한 케모카인 수용체인 CCR8에 결합하여 항체 의존성 세포 독성(ADCC)을 유도할 수 있다면, 효과적인 조절 T세포의 제거가 가능할 수 있다. 조절 T세포는 다양한 경로로 면역 억제를 유도하기 때문에 산업계와 시장은 이들 표면에 발현되는 마커에 관심이 많다. 위에서 언급한 TIGIT도 조절 T세포 표면에 다수 발현된다.
앞에서 언급했듯 아커스의 항TIGIT항체 파이프라인에는 Fc silent 버전뿐만 아니라, effector function을 발휘할 수 있는 야생형(wild type) 버전도 있다. 이를 통해 기대할 수 있는 것은 조절 T세포의 제거에 있다. 조절 T세포를 제어하는 것도 길리어드의 주된 관심 분야라는 것을 알 수 있다. 이는 면역항암제 개발을 둘러싼 공통 관심사이기 때문에 그리 놀라운 일은 아니다.
아커스는 자사의 가장 큰 강점으로 내부 포트폴리오를 통한 차별화된 임상 개발 역량을 강조한다. 자신들이 개발한 항PD-1항체, 항TIGIT항체, CD73 antagonist, A2AR/A2BR 길항제는 다수 암종, 여러 치료 라인, 다양한 병용요법 조합으로 클리닉에 진입했다. 개별 암종과 이들 타깃의 상호작용에 대한 이해도는 매우 높을 것이다. 길리어드가 아커스를 선택한 결정적인 이유라고 본다.
작년 옵션 딜과 올해 옵션 실행에 따라, 길리어드가 아커스에 지불한 현금과 지분 투자액은 약 1조 6,000억원이다(현재 길리어드는 아커스 지분 19.7%를 보유 중). 더불어 옵션 딜의 기한은 10년이다. 길리어드는 향후 10년 동안 현재 진행 중인 임상 파이프라인뿐만 아니라, 앞으로 임상에 진입할 여러 후보물질, 기타 발굴 물질에 접근할 수 있는 권리를 얻었다. 수면 아래에 대한 기대감도 반영된 것이다. 또한 이번에 옵션 행사한 파이프라인의 미국 내 상용화는 양사가 함께 하며 비용과 수익을 공유한다. 향후 아커스에게는 물질 발굴, 임상 개발을 넘어 상용화까지 경험할 수 있는 기회가 될 것이다.
바이오텍에게는 회사와 장기간 동반 성장을 모색할 수 있는 건강한 투자가가 필요하지만, R&D를 함께 할 든든한 동반자도 필요하다. 우리나라 바이오텍에게도 분명히 기회가 있을 것이다.

