지현배 박사의 샌디에이고 통신 [5]
코로나바이러스 mRNA 백신 개발은 팬더믹의 위기에서 전세계 인류를 구한 과학적인 성과이며 동시에 향후 바이오 경제에서 mRNA 를 기반으로 한 기술이 갖고 있는 잠재성을 보여주고 있다. 특별히 바이오 산업의 역사에서 바이오 혁명이라고 인식되고 있는 유전자 재조합 기술이 갖고 있었던 특징들을 살펴봄으로 mRNA 기반 기술이 갖고 있는 잠재성을 평가해 보고자 한다. mRNA 기반 기술은 다음과 같은 2가지 조건을 갖춤으로 유전자 재조합 기술과 더불어 바이오 산업 분야에서 혁명으로 발전할 가능성을 예고하고 있다. 즉, mRNA 기반 기술은 ‘새로운 가치의 창출’과 인간 삶의 질을 향상시키는 ‘지속 가능한 비전 제시’ 라는 두 가지 축으로 구성된 바이오 혁명의 조건들을 갖추고 있다. 본 기고문에서는 유전자 재조합 기술과의 유사성과 차이점을 서술함으로 mRNA 기반 기술이 갖고 있는 잠재성을 논의하고자 한다.
새로운 가치의 창출
현대 바이오테크놀로지의 역사는 40여년 전 유전자 재조합 기술의 발명과 함께 시작되었다. 이 분야에서 가장 독보적인 회사들 중 하나는 제넨텍 (Genentech)으로 오늘 날의 현대 바이오텍 회사들의 대표적인 예가 되었다.
년 과학자들은 대장균 (Escherichia coli, E. coli )을 유전자 재조합 기술을 통해 항생제에 저항성을 갖게 하는 외부 유전자를 발현시키려는 시도를 했고 이 연구는 현대 바이오테크놀로지의 시초가 되었다. 이러한 새로운 기술은 치료용 단백질을 생산하는 방법을 현저하게 개선시키는 혁명적인 잠재성을 갖고 있었다. 즉, 식물이나 동물에서 치료용 단백질을 생산하는 전통적인 방법은 비효율적이었지만 박테리아에서 대규모의 단백질을 생산할 수 있는 유전자 재조합 기술은 효율적이고 혁신적이었기 때문에 바이오 산업의 근간이 된 것이다.
그러나 기술이 혁명적 사건이 되기 위해서는 시장에 도입될 필요성이 있었다. 1976년 1월 UCSF 교수였던 Herbert Boyer는 유전자 재조합 기술에 관심을 갖고 있었던 벤처 투자가였던 Robert Swanson 으로부터 전화 한통을 받게 된다. Robert Swanson 은 매우 꺼려하는 Herbert Boyer에게 몇 분 동안의 미팅을 요청했고 실제로 미팅은 몇 시간 동안 지속되었다. 두 사람은 당시 500 달러를 투자하기로 합의하고 Boyer 는 유전자 엔지니어링 기술 (gene engineering technology)의 단어에서 유래된 Genentech 을 회사의 이름으로 지었다.
1976년 4월 7일 Genentech 은 자산, 시험 시설, 심지어 비서도 없이 설립되었다. 그리고 1977년 대장균을 통해 인간의 단백질인 ‘somatostatin’ 을 유전자 재조합 기술의 개념적 증명 (proof-of-concept) 위해 생산해 냈다. 2년 후 Genentech 은 이 기술을 이용하여 인간의 인슐린을 생산하는데 성공했다. 이 사건은 바이오 산업계에서 혁명적인 성과였다. 왜냐하면 이전에 글로벌 기업인 Eli Lilly 는2톤 이상이 되는 돼지의 췌장에서 인슐린을 고작 226.8g 을 얻어냈다. 즉, 시간과 비용적인 측면에서 매우 비효율적이라는 점을 고려한다면 Genentech 의 유전자 재조합 기술이 얼마나 혁명적인 사건인지를 가늠해 볼 수 있는 것이다. 이 성공 이후 1980년 Genentech 은 주식 시장에 3,500만 달러(지금으로 환산하면 약 $115M)를 조달하여 최초의 생명 공학 회사가 되었다. 이후 2009년에 Genentech 은 스위스의 Roche에 합병된다. 현재 Genentech 은 1만 5천명이 넘는 직원들과 여러 블록버스터 약물들과 대규모 개발 파이프라인을 통해 학계 및 산업계와 협력 관계를 유지하며 치료 항체를 포함하는 다양한 약물들을 개발하고 있다. Genentech 은 유전자 재조합이라는 신기술을 통해 ‘새로운 가치 창출’ 이라는 바이오 혁명의 조건을 제시한 대표적인 예가 되었다.
그렇다면 mRNA 기반 기술은 새로운 가치 창출을 하는 바이오 산업의 혁명적인 조건을 갖추고 있을까?
유전자 재조합 기술을 이용한다 할지라도 항체를 포함하는 치료용 단백질을 생산하기 위해서는 많은 시간이 걸리고 매우 복합적인 과정과 고가의 생산 시설이 필요하다. 따라서 이러한 치료용 단백질을 생산하는데 소요되는 장 시간과 고가의 생산 시설들은 바이오 약물의 높은 약값의 직접적인 원인이 되고 있다. 이에 반해 mRNA 기반 약물들을 생산하는데 걸리는 시간은 상대적으로 매우 짧다. 이미 이러한 사실은 기존의 백신 개발보다 현저히 빠른 코로나바이러스 mRNA 백신 개발의 속도를 통해 잘 알려져 있다. 비용적 측면에서도 mRNA 기반 약물 개발은 기존의 유전자 재조합 기술을 기반으로 한 약물보다 월등히 저렴하다. 예를 들어, PD-1 길항제와 같은 면역 치료용 항체는 4 번 주사에 약 12만 5천 달러 정도가 소요된다. 이러한 고비용은 앞에서 설명한 바와 같이 항체를 생산하기 위한 복합적인 과정과 연관된 고가의 시설을 사용하기 때문에 발생한다.
반해 mRNA 기반 약물을 생산하는 과정은 대부분 in vitro transcription (IVT)라 불리는 과정, 즉 단순히 말하면 시험관에서 생산이 가능하기 때문에 전통적인 바이오테크놀로지에 소요되는 고가의 생산 시설이 필요하지 않다. 또한 생산된 mRNA 약물은 우리 몸에서 해당 치료용 단백질로 발현되기 때문에 우리 몸이 고가의 생산 시설을 대체할 수 있는 것이다. 따라서 mRNA 기술은 유전자 재조합 기술을 이용한 치료용 단백질에 소요되는 약물 생산에 소요되는 비용을 현저히 낮출 수 있는 분명한 장점이 있다. 예를 들어, 모더나 (Moderna) 사는 아열대 지역에서 모기에 의해 발생되는 치쿤군야 (chikungunya) 바이러스를 중화시키는 항체를 발현하는 mRNA 약물 (mRNA-1944)을 임상 시험 중에 있다. 즉, mRNA-1944 를 lipid nanoparticle (LNP) 에 넣어 주사하게 되면 항-바이러스 항체가 발현되어 치쿤군야 바이러스를 중화시키는 것이다. 앞에서 언급한 바와 같이 치쿤군야 감염은 아열대 지역에 위치한 저개발 도상국에서 발생되고 현재 예방용 백신과 효과적인 치료제가 없는 실정이다. 유전자 재조합 기술로 중화 항체를 생산하게 되면 그 비용이 높기때문에 저개발 국가에서는 사용하지 못하게 된다. 따라서 중화 항체를 발현하는 mRNA 약물은 현재 유전자 재조합으로 생산되고 있는 대부분 항체들이 갖고 있는 고비용의 문제를 해결할 수 있는 대안으로 떠오르고 있다.
mRNA 기반 기술이 갖고 있는 새로운 가치 창출의 잠재성은 구체적인 수치로 나타나고 있다. mRNA 약물에 대한 글로벌 시장은 2021년 $46.7 billion에서 2026년 $101.3 billion 으로 증가하여 이 기간 중 연성장률 (compound annual growth rate, CAGR)이 16.8% 로 빠르게 성장할 것으로 예상되고 있다. 또한 코로나바이러스 mRNA 백신을 개발한 모더나의 시가 총액은 10월 현재 $130 Billion 으로 급증했고 주식은 팬더믹 이전보다 1600 배 이상 상승되었다. 현재 모더나의 시가 총액은 글로벌 기업인GlaxoSmithKline (GSK)의 시가 총액인 $96 Billion 을 능가하고 있다. 2018년에 IPO 에 등록되어 불과 3년밖에 지나지않은 모더나가 40년이 된 글로벌기업인 GSK 의 시가 총액을 초월한 것이다. 이러한 수치들은 향후 mRNA 기반 기술이 새로운 가치를 창출할 수 있는 잠재성을 갖고 있음을 명확히 암시하고 있다.
지속 가능한 비전 제시
바이오산업에서 혁명적인 기술의 두번째 조건은 인간 삶의 질을 향상시키는 지속 가능한 비젼을 제시해야 한다. 즉, 단타성의 대박 약물로 끊나는 경우 지속 가능한 비젼을 제시했다고 할 수 없는 것이다. 코로나바이러스 팬더믹으로 인해 mRNA 백신은 다양한 매체를 통해 헤드라인을 장식했다. 백신이외의 치료적 잠재성으로 인해 바이오텍과 제약사들은 mRNA 기술을 이용하여 암에서부터 심장과 호흡기 질환들을 포함하는 다양한 질병들을 치료하기 위해 그 적용 분야를 확장하고 있다.
향후 약물 개발의 비전 제시
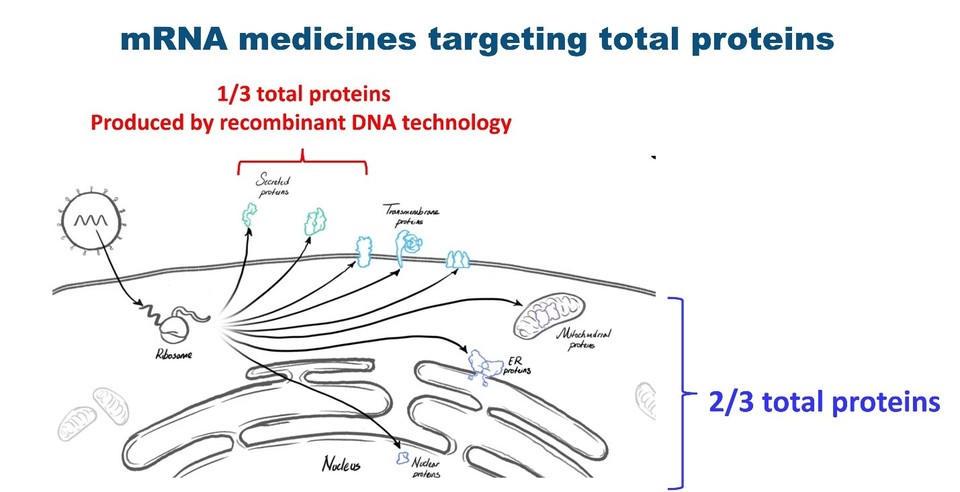
재조합 기술에 의해 생산된 치료용 항체나 단백질 치료제들은 세포 밖으로 분비되는 단백질들이나 세포막 단백질을 타깃한다. 그러나 이러한 단백질들은 세포에서 발현되는 전체 단백질들 중 3분의 1을 차지한다. 나머지 3분의 2의 단백질은 전사 인자들, 세포 신호 전달 단백질, 미토콘드리아에 연관 단백질들처럼 세포 내에 존재한다 (그림 1). 즉, 재조합 기술로 만들어진 약물들은 세포 안에 존재하는 단백질들을 직접적으로 타깃하는 것에 한계성을 갖고 있다. 이에 반해 mRNA 를 기반으로 하는 치료제는 세포 밖으로 분비되는 단백질과 세포막 단백질들 뿐 아니라 세포 안에 존재하는 단백질들까지 타깃화 할 수 있기 때문에 그 만큼 타깃 선택의 폭이 넓은 것이다. 결국 이러한 mRNA 기반 약물들이 갖고 있는 타깃에 대한 확장성은 좀더 다양한 질병으로 적용할 수 있는 작용 기작의 기반이 되고 있다. 따라서 mRNA 기반 약물들은 차세대 약물 개발의 새로운 방향을 제시할 수 있다. 즉 mRNA 기반 약물들은 과학적 증거를 바탕으로 향후 차세대 약물 개발의 비젼을 제시하는 새로운 틀을 마련하고 있다.
코로나바이러스 mRNA 백신 개발을 통한 비전 제시
수십 년간의 연구와 경험의 축적을 바탕으로 코로나바이러스 팬더믹 상황은 mRNA백신을 새로운 방식으로 전면에 내세웠고 마침내 이 전염병에서 그 유용성을 입증하여 백신 개발에서 획기적인 전환기를 마련했다. mRNA 백신을 주사하면 코로나바이러스 감염에서 핵심적인 역할을 하는 스파이크 단백질이 발현되어 면역이 자극되고 이어서 바이러스를 중화시키는 항체들이 만들어진다. 즉 mRNA 백신에 의해 형성된 항체들이 코로나바이러스의 감염을 차단하는 역할을 하는 것이다.
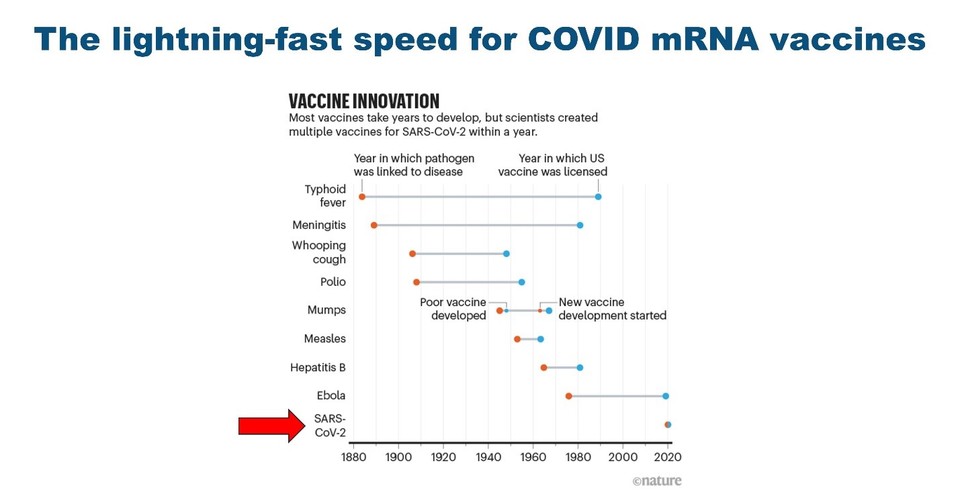
를 기반으로 한 백신 개발은 예방 백신을 만들 수 있는 매력적인 기회를 제공한다는 의견에는 의문의 여지가 없다. 전통적인 방식과 비교해 볼 때 mRNA 기반 약물들은 신속한 개발과 제조를 통해 대규모 생산이 가능하다. 잘 알려져 있듯이 코로나바이러스 mRNA 백신 개발은 불과 1년밖에 걸리지 않았다. 이는 수십년 씩 걸리는 기존의 백신 개발에 걸리는 시간과 비교한다면 전례를 볼 수 없는 속도이다 (그림 2). 이렇게 빠른 개발 속도는 신속한 대처가 필요한 신종 감염 질환이나 예측이 정확하지 않은 계절성 독감 바이러스에 대한 백신 개발에 적용할 수 있는 상당한 잠재성을 갖고 있다.
코로나바이러스 mRNA 백신에 대한 신속한 허가는 전체 mRNA 약물 시장에 중요한 영향을 미쳤다. 즉 초고속으로 행해진 연구는 글로벌 수준에서 관련 과학계를 연결했고 질병의 기작과 mRNA 기반 치료제들의 효능을 확인시켰기 때문에 유래를 찾아볼 수 없는 속도의 mRNA 백신 허가가 가능했던 것이다. 즉, 코로나바이러스 mRNA 백신 개발에서 축적된 이러한 경험은 다른 감염 질환들뿐만 아니라 다양한 질병들을 위한 약물 개발과 허가 과정에도 영향을 줄 것으로 전망되고 있다. 또한 코로나바이러스 mRNA 백신 개발과정에서 형성된 제조 공정의 신속한 확장은 생명공학과 글로벌 대기업, 여러 계약 개발 및 제조 조직(contract development and manufacturing organizations, CDMO) 및 기술 제공업체 간의 협력을 촉진시켰다. 궁극적으로 이러한 요소들은 향후 전개될 다양한 mRNA 기반 약물들의 개발 속도를 가속화할 것으로 전망된다.
다양한 질병에 대한 확장성의 비전 제시
mRNA 기반 기술은 감염성과 암과 같이 면역과 연관된 질환들에 적용될 수 있지만 동시에 면역 결핍증과 같이 손실된 단백질과 돌연변이로 인한 질환들을 치료하는데도 광범위하게 적용될 수 있다. 현재 mRNA 기반 약물들은 임상 초기 단계에 있지만 고무적인 결과들을 보여주고 있다 (그림 3). 또한 임상에 들어간 mRNA 기반 약물들의 약 60% 는 고형암 치료제 개발에 집중되어 있고 그 밖에 나머지는 항바이러스와 같은 감염 질환, 신진대사 연관 질환, 심장 질환과 호흡기 질환을 위한 치료제들이다.
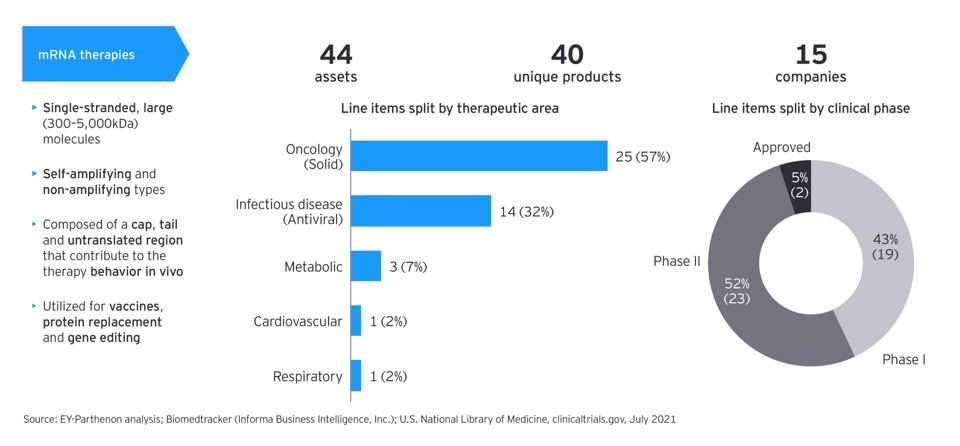
최근 mRNA 기반 치료제의 개발은 큰 주목을 받고 있지만, 아이디어를 임상에 적용할 수 있는 기업들은 극 소수에 불과하다. 또한 앞에서 언급한 바와 같이 코로나바이러스 mRNA 백신 개발에서 입증된 신속하고 효과적이며 성공적인 약물의 공급이 다른 질병에 대한 치료제 개발에도 적용될 수 있을 지는 지켜볼 일이다. 즉, 면역 반응을 자극하는 코로나바이러스 mRNA 백신 개발의 성공이 신진대사 관련 효소들, 호르몬과 치료용 항체처럼 작용 기작이 다른 약물들의 개발에서도 재현될 지는 미지수이다. 또한 유전적인 다양성과 mRNA 의 불안정성을 고려해야 하는 대부분의 암 치료제 개발은 대량 생산이 아닌 개인화 맞춤 치료 전략으로 방향이 정해지고 있다. 또한 지질 나노입자를 통해 전달되는 mRNA 치료제의 효능이 얼마나 지속될 수 있는 지도 좀더 연구가 필요한 실정이다.
팬더믹 이후 코로나바이러스 백신 시장은 유동적이지만 감염질환에 대한 예방 백신 시장에서 mRNA 기반 백신은 실질적인 점유율을 차지할 것으로 전망된다. 또한 새로운 치료제 형태의 개념으로 mRNA 플랫폼은 계속해서 발전할 것으로 예상되고 있다. 코로나바이러스 mRNA 백신의 성공덕분에 mRNA 기술을 기반으로 한 수많은 스탓업들이 주로 미국과 유럽 국가들에 세워지고 있고 4.6 Billion 달러의 대규모 투자금을 확보한 것으로 보고되었다.
현재 개발 중인 mRNA 를 기반으로 한 약물들 중 감염병 질환들에 대한 약물은 암 치료용 약물 다음으로 약 30%를 차지하고 있다. 앞에서 언급한 바와 같이 mRNA 기반 기술은 매우 다양한 질환들을 치료하는데 응용될 것으로 예상된다. 그러나 mRNA 기반 기술이 다양한 질병을 치료하는데 적용되기 위해서는 작용 기작에 대한 폭넓은 이해와 경험 및 과학적이며 임상적 증거들이 여전히 필요한 실정이다.
또한 mRNA 전달은 극복해야 할 여러 도전적인 문제들이 존재한다. 특별히 적절한 조직 으로의 전달, 세포 유입과 약동학 (pharmacokinetic) 과 약력학 (pharmacodynamic) 성능을 위한 전달체를 개발하는 연구는 매우 핵심적인 분야가 될 것으로 전망된다. 즉, 코로나바이러스 mRNA에 사용되었던 지질 나노입자 (lipid nanoparticles, LNPs)와 같이 mRNA 분자를 적절히 감싸는 안정적인 지질로 구성된 나노입자를 개발하는 연구가 활발히 전개될 것으로 예상된다.
비전 실현을 위한 첫걸음
여러 이슈들에도 불구하고 mRNA 기반 기술은 새로운 형태의 차세대 약물 개발에서 혁신적인 프랫폼이 될 것으로 전망되고 있다. 향후 전략적 측면에서 mRNA 기반 기술 과 관련 약물들의 성공을 위해서 다음 두 가지 중요한 요소들이 고려되어야 한다.
첫째, mRNA 치료제의 대량 생산을 위한 인프라의 구축이 선행되어야 한다. 즉, 당뇨병과 심장 질환들과 같이 일반적으로 많은 수의 환자들을 치료하는 약물의 경우 대량 생산 체제가 요구된다. mRNA 제조의 특성을 감안할 때 제약 회사는 내부 역량을 확장해야 할 뿐만 아니라 외부 제조업체 및 기타 대형 제약 회사들과 협력해야 한다. 코로나바이러스 mRNA 백신 개발에서 형성된 인프라의 구축은 향후 전개될 새로운 mRNA 기반 약물의 파이프라인을 구축하는데 매우 중요한 요소가 될 것으로 전망된다.
둘째, mRNA 를 기반으로 한 약물이 성공할 수 있는 적소(niche)를 동정하는 것이다. 즉, 희귀 질환들이나 특정 암과 같이 소규모이지만 매우 개인화된 질병들을 동정하고 이런 질환들에 대한 mRNA 치료제 개발에 초점을 맞추는 것이다. 이런 전략을 잘 세운다면 한국 제약사들도 혁신적인 mRNA 를 기반으로 한 약물을 개발할 수 있는 기회를 마련할 수 있을 것으로 기대된다.
향후 mRNA 를 기반으로 한 치료제 개발은 계속 가속화될 것으로 예상되고 있기 때문에 관련 기업들, 투자자들과 규제 기관들 모두로부터 상당한 관심을 받고 있다. 최초로 승인된 코로나바이러스 mRNA 약물의 성공은 향후 다양한 질병들에 대한 새로운 치료제 개발의 장을 마련했다. mRNA를 기반으로 한 약물을 개발하기로 결정한 기업들은 경쟁사들의 파이프라인의 개발을 면밀히 추적하고, 업계 표준과 잠재적인 차별화 포인트를 식별하며 mRNA 약물들의 포트폴리오를 조기에 형성해야 한다.
mRNA 기술은 상대적으로 새롭게 등장했다는 점을 감할 때 mRNA 약물을 개발하려고 하는 다양한 제약 기업들은 관련 과학, 시스템 및 인프라의 세 가지 핵심적인 요소들을 구축해야 할 것이다. 기업들은 신뢰성 있는 mRNA 약물을 개발함으로 사회에 기여하는 새로운 가치를 창출하고 지속 가능한 비젼을 보여주며 궁극적으로 인간 삶의 질을 향상시키는 긍정적인 메시지를 제시해야 한다. 팬데믹 이후의 세계에서 관련 분야의 전문가들은 mRNA 를 기반으로 한 약물들이 지속적으로 의료적 혜택을 제공할 수 있는 풍부한 기회를 마련할 것으로 전망하고 있다. 아직 확실하게 말하기는 이르지만 mRNA 를 기반으로 한 약물들은 제약 산업에서 새롭게 떠오르는 별이 될 수 있는 유리한 위치에 있는 것만은 틀림이 없다. 즉, 코로나바이러스 백신의 성공을 통해 mRNA 기술은 유전자 재조합 기술이 보여주었던 바이오 혁명의 조건들을 갖추고 있음을 인식할 필요성이 있는 것이다.

