기술진전 불구 개발속도 더뎌...3차원 세포분화등 기술융합 움직임
매년 10월이면 노벨 생리학상/의학상 수상자가 발표되고, 사람들이 생물학을 포함한 과학에 관심을 갖게 되는 시기이다. 지난 기사에서 짧은 간섭 RNA(small interference RNA)를 소개하면서, 1998년 앤드류 파이어 박사와 크레이그 멜로 박사가 siRNA 연구 발표를 하고, 10년이 채 안된 2006년에 노벨상 생리학 수상자들이 되면서, 그 당시 siRNA에 관한 관심이 굉장했음을 이야기했다.
<관련기사> 앨나일람 2조 투자, 왜?...보폭 넓히는 siRNA 신약개발
이와 비슷한 일이 지난 2012년에 또 일어났다. 일본의 신야 야마나카 박사가 유도 만능 줄기 세포 (induced pluripotent stem cell, iPSC)에 대해 2006년에 연구 발표를 하고, 6년 밖에 지나지 않은 2012년에 영국의 존 골든 박사와 함께 노벨 생리학상을 받았다. 발표와 수상의 시간이 이례적으로 짧은 것을 통해, 유도 만능 줄기 세포의 영향력과 관심이 그 당시 얼마나 컸는지 알 수 있다.
만능 줄기 세포(Pluripotent Stem Cells)의 역사
만능 줄기 세포 (PSC)는 어디서 유래를 하느냐에 따라 배아 줄기 세포 (Embryonic stem cell, ESC)와 유도 만능 줄기 세포 (induced pluripotent stem cell, iPSC)로 나뉜다. 배아 줄기 세포는 배아를 통해, 유도 만능 줄기 세포는 성체의 체세포를 사용해 만든다. 인간 배아 줄기 세포 (human ESC)는 1998년 미국 위스콘신 대학의 제임스 톰슨 박사에 의해 보고되었다. 톰슨 박사는 인간 배아 (Embryo)에 있는 내세포집단 (Inner cell mass)에서 세포를 추출해서, 쥐의 피부 세포를 배양 지원 세포로 깐 배양 접시에 옮기고, 피부세포 성장 인자 (Fibroblast Growth Factor, FGF)가 포함된 배양액을 음식으로 줘서 계대 배양 (subculture)을 통해 키움으로 인간 배아 줄기 세포를 처음으로 만들었다(1). 하지만, 배아를 사용한다는 윤리적인 문제로 인해 2001년 미국 부시 정부가 인간 배아 줄기 세포에 대한 연방 정부 연구비 사용을 막음으로써 한동안 연구 진행에 어려움이 있었다.
그러던 중, 야마나카 박사가 2006년 쥐의 피부 체세포에, 그리고 2007년 인간의 피부 체세포에 4개의 전사 인자 (Oct-4, Klf4, Sox2, c-Myc)를 바이러스를 통해 인위적으로 과발현시키고, 배아 만능 줄기 세포와 같이, 쥐의 피부세포를 배양 지원세포로 깔고, FGF가 들어 있는 배양액으로 한달 정도 키우면, 배아 줄기 세포와 형태와 기능성이 거의 비슷한 유도 만능 줄기 세포를 만들 수 있음을 보고했다(2). 배아를 사용하지 않고, 체세포를 사용함으로써 윤리적인 문제가 어느 정도 해결되었다. 이에 따라, 각 나라의 정부 연구비와 상업화를 위한 투자가 상당히 이루어져 재생의학이 굉장히 발전하였다.
만능 줄기 세포의 특징과 응용
만능 줄기 세포는 기능적으로 두가지 큰 특징이 있다. 첫번째는 암세포와 마찬가지로 계속 자가 증식(Self-renewal)을 한다는 것이다. 자가 증식을 통해 세포 은행을 구축할 수 있어서, 사용자가 항상 같은 세포로 되돌아가 사용할 수 있다는 장점이 있다. 더 중요한 두번째 특징은 암세포와는 다르게 만능성 (Pluripotency)이 있다는 것이다. 암세포는 유래된 원래 조직의 세포로만 자가 증식을 하지만 (예를 들어, 간암 추출 세포는 간세포로만), 줄기 세포는 만능성을 통해 이론적으로 몸의 모든 세포로 분화(differentiation)가 가능하다.
이 두 가지 특징을 통해, 사용자는 언제든 세포 은행에 저장된 인간 만능 줄기 세포로 돌아가, 연구나 치료에 필요한 조직의 세포로 만들 수 있게 되었다. 이를 통해, 인간 만능 줄기 세포는 인간 발달(human development) 과정에 대한 기초 연구 발전뿐 아니라, 질환 모델 (Disease modelling) 또는 세포 치료법 (Cell therapy)과 같은 응용 연구 발전에도 큰 기여를 하였다.
줄기 세포를 사용한 대표적인 질환 모델(Disease modelling)의 예로는 치명적인 심실 부정맥인 QT간격 연장증후군 (long QT syndrome) 모델을 들 수 있다. 이 증후군은 심실 재분극 이상에 의해, 빠르면서 무질서한 다형 심실 빈맥 (Torsade de pointes)을 일으켜 돌연사를 일으킬 수 있다. 2011년에 발표된 연구에 의하면(3), 선천성으로 이 증후군을 보이는 사람의 체세포에서 유도 만능 줄기 세포를 만들고, 그 후에 심장 세포로 분화시켜 보았더니(그림1a), 배양 접시 안에서 심장 세포가 박동을 하는 것을 관찰할 수 있었다. 더욱 재미있는 점은 정상인의 체세포로 똑같은 과정으로 심장 세포를 만들어서 심장 전기 생리 검사를 통해 심장 박동을 측정해 보니(그림 1b), 환자의 심장세포가 부정맥(그림 1c)과 염전성 심실 빈맥(그림 1d)을 보이는 것을 관찰할 수 있었다. 마지막으로 다양한 약물을 처리했을 때 전기 생리 검사 지표상 박동이 빨라 지기도 느려 지기도 하는 것을 확인할 수 있었다(그림1e).
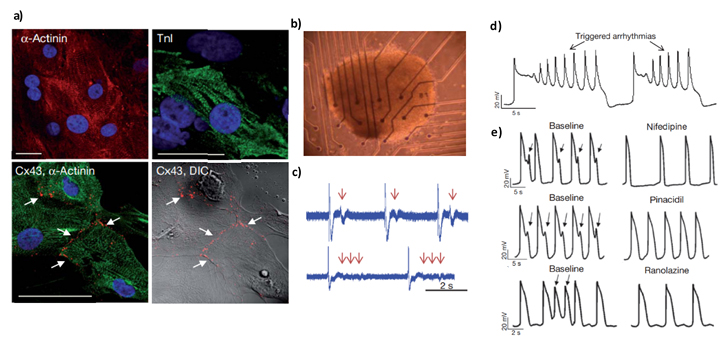
이 논문의 발표로, 미국 FDA에선 2013년 이후 CiPA(Comprehensive In Vitro Proarrhythmia Assay)를 출범하였다(3). 신약 후보 물질의 임상 실험 신청 때 확인해야 하는 심장 독성 평가 방법의 하나로 인간 유도 만능 줄기 세포에서 분화된 심장 세포를 이용해 심부정맥 유도 부작용을 검사하는 방법을 추천하고 있다(4). 또한, 한국 식품 의약품 안전 평가원에서도 2017년 이후로 같은 질환 모델을 추천하고 있다(5).
만능 줄기 세포가 많은 관심을 받는 또 다른 적용 분야는 세포 치료제이다. 인간 유도 만능 줄기 세포를 이용한 첫번째 세포치료 적용 사례는 2013년 일본의 RIKEN 연구소 소속 마사요 타카하시 의학박사에 의해 진행된 퇴행성 안과 질환인 노인 황반 변성 (Age-related Macular Degeneration, AMD) 치료 시도였고, 그 결과는 2017년에 학계에 발표되었다(6). 이 안과 질환을 앓고 있는 환자의 체세포로부터 유도 만능 줄기 세포를 만들고, 그 것을 망막 색소 상피 세포 (Retinal Pigment Epithelium, RPE)로 분화 시켜 환자의 눈에 직접 이식을 하였고, 그 진행 과정을 현재까지도 확인 중에 있다.
이 사례의 큰 의의는 세계에서 첫번째로 공식적으로 시도된 유도 만능 줄기 세포의 자가 세포 치료 요법(autologous cell therapy)이였다는 점과, 무엇보다도 환자에게서 암 발생 등의 부작용이 현재까지 관찰되지 않는다는 점이다. 앞에서 만능 줄기 세포의 첫번째 특징이 자가 증식이라고 기술했는데, 만약 이식한 망막 색소 상피 세포 중에 단 하나의 만능 줄기 세포라도 포함되어 있었다면, 자가 증식을 통해 암이 생겼을 가능성이 아주 많았으나, 현재까지도 암이 발생하지 않았다는 것은 굉장히 고무적인 일이다.
이후로, 만능 줄기 세포를 세포치료제로 상업화하려는 회사들이 일본과 미국을 포함한 많은 나라에서 생겼다. 2015년 일본의 후지필름이 제임스 톰슨 박사가 공동 창업자로 설립한 Cellular Dynamics International을 합병함으로써 줄기 세포 시장의 큰 선두 주자가 되었다(7). 후지필름 CDI는 초기엔 만능 줄기 세포로부터 분화된 특정 세포를 각 국의 연구소 및 회사들에 공급하는 사업 모델로 매출을 증가시키고 있으며, 현재는 많은 협력 연구를 통해 세포 치료제 회사로 성장하고 있다.
Bluerock Therapeutics는 2016년 매사추세츠주 캠브리지에서 시작해서, 2019년에 Bayer 제약회사에 합병되었다. 이 회사는 지난 7월 19일 FDA로부터 파킨슨병 환자들에게 만능 줄기 세포 유래 도파민 신경 세포를 이식할 수 있도록 임상 1상 실시 허가를 받았다(8). Fate Therapeutics는 2007년 샌디에고에서 시작한 회사로, 초기엔 화학물질을 이용해서 4개의 전사 인자를 과발현시켜 유도 만능 줄기 세포를 제조하고 분화 기술 개발에 집중했으나, 최근 연구 개발 방향을 바꿔서 유도 만능 줄기 세포를 다양한 면역 세포들로 분화시켜 항암 치료제로 개발 중이며, 현재 6개의 임상 1상 연구를 진행하고 있다(9). Century Therapeutics는 2018년 필라델피아에서 시작했고, 만능 줄기 세포를 자연 살해 세포 (natural killer cell)와 T 세포로 분화시켜 항암치료제로 개발 중이다(10). Sana Biotechnology는 2018년 시애틀에서 시작했고, 만능 줄기 세포를 베타 세포, 신경 아교 전세포, 심장세포로 분화시켜 각각 제 1형 당뇨병, 헌팅턴씨 병, 심장발작 치료제로 개발 중이다(11).
만능 줄기 세포 상용화 장벽 및 극복 노력
만능 줄기 세포의 상업화 발전 가능성은 굉장히 크지만, 현실화하는데 넘어야 할 장벽들이 여전히 존재한다. 일단, 시간적인 면에서 보면 방법에 따라 차이는 있으나 만능 줄기 세포를 만드는데 최소 한달 정도 걸리고, 환자 이식에 필요한 세포 (예를 들어, 심장 세포 또는 도파민 신경 세포 등)로 분화 시키는데 적게는 2주, 길게는 6달 정도가 걸린다. 그래서, 전체적인 시간을 보면 2달에서 12개월 정도 걸리는데, 자가 세포 치료제로 쓰기에는 여전히 부담스러운 기간이다. 더불어, 비용적인 면에서 보면, 줄기 세포 배양액이 항체 대량 생산에 사용되는 세포주들의 것보다 비싸며, 세포 배양 중간 조작 과정이 여전히 많은 부분 자동이 아닌 수동이어서 노동에 대한 비용이 많이 든다. 또한, 연구자에 의한 수동 조작 방법으로 인해 대량 생산하기 위한 공정 개발이 쉽지 않다는 어려움이 있다. 이를 극복하기 위해 다양한 방법들이 개발되고 있다.
우선 시간을 절약하기 위해, CRISPR/Cas9과 같은 유전자 조작 기술로 HLA 유전자를 변형하여 면역 반응을 회피하도록 하여 자가 세포 치료제(Autologous Cell Therapy)보다 동종 세포 치료제(Allogeneic Cell Therapy)를 만들려는 연구가 진행 중이다. 그래서, 세포 은행을 줄기 세포 단계에서 만드는 것뿐 아니라, 최종적으로 환자 이식에 필요한 세포의 전구 세포 단계에서 만들어서, HLA 유전자 타입에 상관없이 투여하려는 시도가 활발히 진행되고 있다. 대표적인 회사로는 2013년 시애틀에서 설립된Universal Cells가 있다. 이 회사는 2017년 Bluerock Therapeutics와 면역회피 만능 줄기 세포를 이용한 동종 세포 치료제 협력 개발 계약을 성사시켰고(12), 2018년 일본의 Astella 회사에 합병되었다(13).
두번째로 비용을 절감하기 위해 공정의 자동화를 강력히 추진 중에 있다. 줄기세포 쪽에서 굉장히 큰 비영리 연구 단체인 뉴욕 줄기 세포 재단(New York Stem Cell Foundation)은 2013년엔 형광 물질을 이용한 세포 분리 기술을 통해 체세포로부터 유래된 만능 줄기 세포만을 체세포로부터 분리해 내는 논문 발표를 시작으로, 2015년엔 배양액 자동 분배 및 교환 장치를 통해 많은 단계를 자동화하는데 성공하였다 (14). 그러나, 비영리 단체인 이유로, 이 세포 자동 배양 기계를 상업화해서 매출을 올리려 하기보단 재단의 연구에만 주로 사용하고 있다. 최근, Cellino Biotech이라는 매사추세츠주 캠브리지에 소재한 회사는 레이져 광학 기술과 머신 러닝을 이용해서 만능성을 잃은 줄기 세포만을 선택적으로 죽여서, 만능성을 갖고 있는 줄기 세포를 대량으로 유지하는 자동화 기계를 개발 중에 있다(15).
세번째로는 만능 줄기 세포 배양액에는 다양한 성장 인자들이 들어가서, 다른 세포 배양액에 비해 값이 비싸다. 그리고, 만능 줄기 세포는 매트릭스에 붙어서 2차원 평면의 원형 모양으로 자라는데, 배양 접시에 꽉 차게 되면 더 이상 분열을 하지 않게 되므로, 세포를 분리시켜 새로운 배양 접시로 넘겨 키우는 계대 배양을 진행해야 한다. 이러한 2차원 세포 배양 방식은 항체 생산 세포주의 배양 방식인 생물 반응 장치 (바이오리액터, Bioreactor)를 이용해 세포를 부유시켜 3차원으로 계대 배양하는 방식에 비해 배양액을 많이 사용하기 때문에 비용이 많이 든다. 이런 문제를 해결하기 위해 노력하는 회사는 프랑스의 TreeFrog Therapeutics가 있다. 이 회사는 특수한 생물 반응 장치 기술을 개발해서 한번에 15조개의 만능 줄기 세포를 부유시켜 3차원으로 계대 배양할 수 있다고 최근 발표를 하였고, 지난 9월 13일에 75밀리언달러의 시리즈 B 자금을 모금을 마감하였다(16).
동종 세포 치료제, 자동화, 그리고 배양 기술의 개발 등을 통해 시간 및 비용 절감이 굉장히 빠르게 진행되고 있지만, 체세포로부터 유도 만능 줄기 세포를 만드는 시간은 아직까지 줄지 않고 있다. 또한, 관련 기술이 빠르게 발전함에 따라 세포 치료제에 대한 규제 지침이 계속 변함으로 인해, 치료제 개발 회사 입장에선 연구 및 개발 전략 방향을 수립하는데 어려움을 겪고 있다(15). 그럼에도 불구하고, 만능 줄기 세포 응용 분야는 3차원 세포 분화 기술 (organoid) 및 장기 엔지니어링 (Tissue engineering), 그리고 유전자 조작 기술과의 융합 사용 등을 통해 발전 가능성이 상당하므로 계속 관심을 갖고 그 성장을 지켜볼 만한 가치가 큰 분야이다.
1. JA Thomson, J Itskovitz-Eldor, SS Shapiro, MA Waknitz, JJ Swiergiel, VS Marshall, JM Jones. (1998) Embryonic stem cell lines derived from human blastocysts Science 282, 1145-1147
2. K Takahashi, K Tanabe, M Ohnuki, M Narita, T Ichisaka, K Tomoda, S Yamanaka. Induction of pluripotent stem cells from adult human fibroblasts by defined factors (2007) Cell 131, 861-872
3. I Itzhaki, L Maizels, I Huber, L Zwi-Dantsis, O Caspi, A Winterstern, O Feldman, A Gepstein, G Arbel, H Hammerman, M Boulos, L Gepstein (2011) Modelling the long QT syndrome with induced pluripotent stem cells Nature 471, 225-229
4. https://cipaproject.org/about-cipa/
5. http://www.nifds.go.kr/brd/m_18/view.do?seq=10307
6. M Mandai et al. Autologous induced stem-cell-derived retinal cells for Macular Degeneration (2017) N Engl J Med 376, 1038-1046
7. https://www.prnewswire.com/news-releases/fujifilm-holdings-to-acquire-cellular-dynamics-international-inc-300057456.html
8. https://www.prnewswire.com/news-releases/bluerock-therapeutics-receives-fda-fast-track-designation-for-da01-in-the-treatment-of-advanced-parkinsons-disease-301336295.html
9. https://fatetherapeutics.com/pipeline/
10. https://www.centurytx.com/pipeline
11. https://sana.com/our-science/
12. https://www.prnewswire.com/news-releases/bluerock-therapeutics-and-universal-cells-enter-collaboration-and-license-agreement-to-generate-gene-edited-ips-cell-lines-300529463.html
13. https://www.prnewswire.com/news-releases/astellas-acquires-universal-cells-inc-300598148.html
14. D Paull et al. Automated, high-throughput derivation, characterization and differentiation of induced pluripotent stem cells (2015) Nature Methods 12, 885-892
15. https://www.nature.com/articles/d41586-021-02627-y
16. https://www.prnewswire.com/news-releases/treefrog-therapeutics-secures-75m-in-series-b-financing-to-advance-a-pipeline-of-stem-cell-derived-cell-therapies-and-deploy-proprietary-c-stem-technology-in-the-usa--japan-301374845.html

