Kim's Weekly 9월 1주차 의약품 품목허가 임상승인 현황
국산 mRNA 백신 후보물질 임상 돌입
빈자리 채우자, 플루옥세틴 3개품목 허가

아이진의 코로나19 mRNA 백신 후보물질이 국내 두번째로 임상시험을 승인받았다. 지난주 식품의약품안전처는 24개 의약품(전문약 15개, 일반약 9개)품목허가와 22(1상 17개, 2상 1개, 3상 2개, 연구자 2개)개 임상시험계획을 각각 승인했다.
국산 mRNA 백신 후보물질 임상 돌입
지난주 임상시험승인현황에는 코로나19 백신과 치료제가 각각 1건 포함됐다.
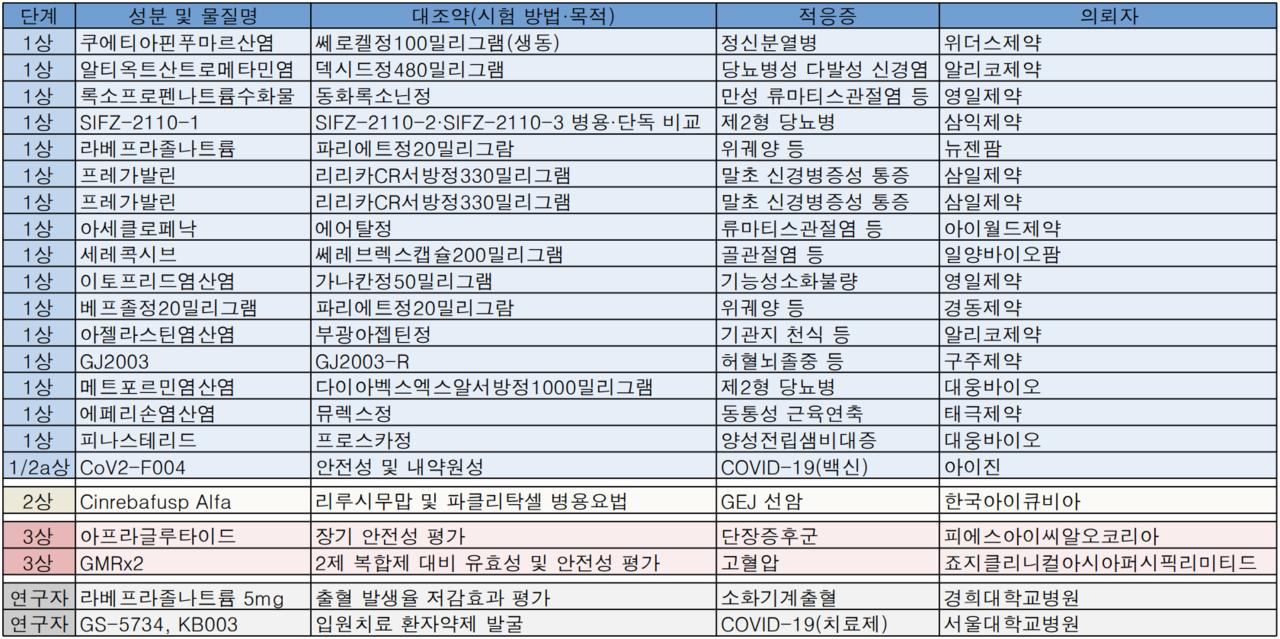
아이진은 코로나19 mRNA 백신에 대한 1/2a상을 이달부터 진행할 예정이다. 1상은 서울아산병원에서 진행되며 45명을 대상으로 안전성과 면역원성 평가에 나선다. 이후 2a상은 1상 결과에 따라 125명을 대상으로 진행된다.
아이진 사업보고서에 따르면 EG-COVID는 유럽발 변이 바이러스를 기반으로 디자인된 mRNA를 포함하고 있으며 동결건조 제형으로 생산됨에 따라 보관온도가 2~8℃로 높다.
치료제 임상시험은 서울대학교병원이 맡는다. 연구자주도 임상시험(IIT)으로 진행되는 이번 시험은 렘데시비르와 렌질루맙에 대한 글로벌임상시험 중 국내 환자 50명(전체 400명)을 대상으로 진행될 예정이다.
임상시험수탁기관 죠지클리니컬아시아퍼시픽리미티드(영업소)는 고혈압 3제 복합제 GMRx2(텔미사르탄, 암로디핀, 인다파미드)에 대한 글로벌임상시험 3상을 승인받았다. 이번 시험은 글로벌 환자 1500명을 대상으로 진행되며 국내는 가톨릭대여의도성모병원, 부산대병원, 분당서울대병원 등에서 100명을 대상으로 진행될 예정이다.
빈자리 채우기, 플루옥세틴 3개품목 허가
지난주 식약처 품목허가에서는 바이넥스 사태로 잇따른 판매중지 처분이 내려진 플루옥세틴염산염 빈자리를 채우려는 움직임이 감지됐다.
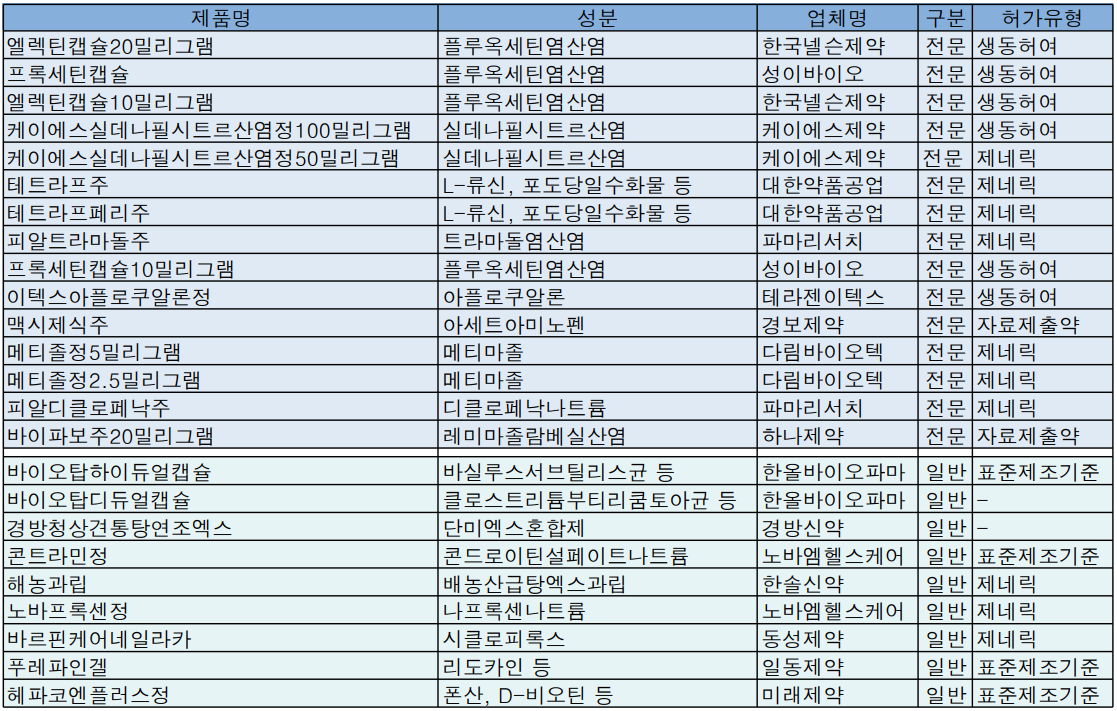
한국넬슨제약과 성이바이오는 '엘렉틴캡슐 20/10밀리그램', '프록세틴캡슐'에 대한 품목허가를 각각 획득했다. 두 품목은 모두 대한뉴팜 '디프렌캡슐' 쌍둥이 약으로 대한뉴팜이 위탁생산한다.
경보제약은 아세트아미노펜과 이부프로펜 복합주사제인 '맥시제식주' 품목허가를 획득했다. 식약처 허가사항에 따르면 맥시제식주는 성인에서 통증으로 인해 신속하게 투여할 필요가 있거나 다른 경로로 투여할 수 없는 중등도~중증 통증(특히 수술 후) 단기간 치료에 사용할 수 있으며, 뉴질렌드 AFT제약 개발 제품으로 2018년 경보제약이 국내 도입계약을 체결한 바 있다.

