박병준 가신길TV 제작자가 본 '글로벌 면역항암제 개발 동향'
새로운 면역억제·자극경로를 타깃으로 하는 초기 임상 다수
주요 빅파마의 후보물질 중, 임상 1/2상 단계에 있는 파이프라인을 통해 면역 항암제의 흐름과 동향을 살펴보고자 한다. 임상 1/2상으로 제한한 것은 현재를 기준으로 지난 과거와 가까운 미래를 모두 보여줄 수 있는 의미 있는 국면이기 때문이다.
역동적인 신약 개발 환경의 미래(5년 후)를 예견하는 것은 매우 어렵다. 하지만, 과거-현재-내일(가까운 미래)을 관통하는 연구, 개발 흐름은 미래를 엿볼 수 있는 단초가 될 것이다.
새로운 면역 억제 경로 탐색
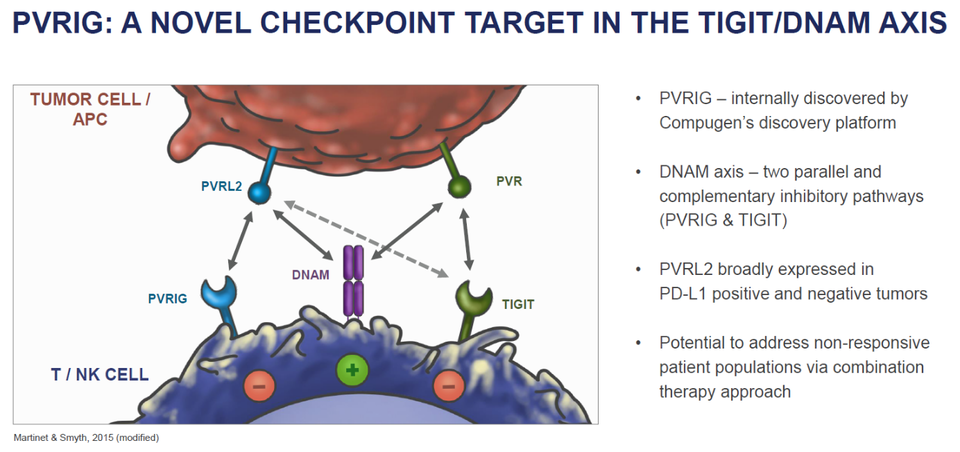
T 세포 기반 신규 타깃 면역관문억제제: TIGIT
PD-(L)1과 시너지를 발휘할 수 있는 새로운 면역관문억제제는 중요하다. 많은 도전이 있었지만, 현시점 여러 임상시험에서 의미 있는 데이터를 도출한 타깃은 TIGIT, LAG3 등이 있다. 특히, TIGIT는 관련 생물학이 점점 구체화되면서 다양한 도전이 펼쳐지고 있다.
로슈(Tiragolumab), 머크(vibostolimab)가 비교적 앞서 있고 면역관문억제제 병용요법에서 의미있는 시너지를 보여줬다. 또한 BMS는 항TIGIT 항체(BMS-986207)뿐만 아니라, 최근 아제너스(Agenus)와의 거래를 통해 TIGIT 이중항체도 도입했다(타깃 미공개). GSK도 아이테오스(iTeos)에서 항TIGIT 항체(EOS-448)를 도입했다. 이들은 기보유 물질인 항PVRIG, 항CD96, 항PD-1 등과 시너지를 탐색할 것이다.
지난 4월, GSK의 항PD-1 항체 도스탈리맙(dostarlimab)은 FDA 승인을 받았다. 글로벌에는 승인받은 anti-PD-(L)1이 굉장히 많다. 이미 승인받은 약물이 이렇게 많은데 뒤늦게 개발하는 것이 다소 이상할 수 있다. 하지만, 견고한 면역 항암제 포트폴리오를 만드는데 있어서 PD-(L)1은 중요하다. PD-(L)1의 역할은 변할 수 있겠지만, 한동안 ‘주연’일 것이고 이후에는 훌륭한 ‘감초’ 역할을 하지 않을까 싶다.

T세포가 아닌 면역 억제 경로 타깃: CD47-SIRPa 축
면역 억제 경로는 T세포에 존재하는 특정 분자에만 기반하는 것은 아니고 다른 면역 세포(골수세포, NK세포 등)에서 발현되는 분자를 통해서도 활성화될 수 있다. 대표적으로 대식세포에서 발현되는 SIRPa와 종양세포에 발현되는 CD47의 상호작용은 '나를 먹지 마세요(Don't eat me)' 라는 신호를 보내 대식 세포의 식세포 작용(phagocytosis)을 막는다.
CD47-SIRPa의 상호작용을 막는 것은 항CD47 혹은 항SIRPa 통해 달성할 수 있다. 항CD47은 길리어드(magrolimab)를 중심으로 몇몇 파마와 바이오텍이 개발 중이다(e.g. Trillium, ALX, Shattuck). 항SIRPa는 베링거인겔하임, BMS, 아치 온콜로지(Arch Oncology), 이노벤트(Innovent) 등이 개발 중인데 항CD47 특유의 혈액학적 독성(빈혈)에서 비교적 자유롭고 단일 약물로 식세포 작용(phagocytosis)을 유도할 수 있다는 점이 주요 장점으로 꼽힌다.

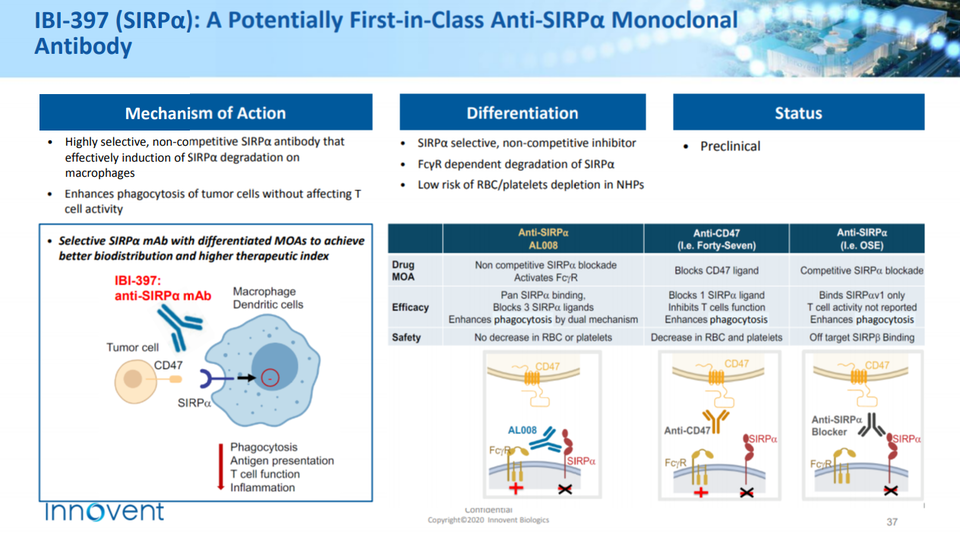
CD47-SIRPa 축은 주로 바이오텍이 개발 중이고 대부분 초기 임상 단계이다. 이들의 임상 데이터가 잘 나온다면, 빅파마가 적극적으로 도입할 수 있다. 현재까지 빅파마가 항CD47을 도입한 사례는 길리어드(Forty Seven), 애브비(I-MAB), 화이자(Trillium Therapeutics)가 있다. 더불어 중국의 이노벤트는 PD-L1/CD47 이중항체(IBI322)로 개발 중이고 최근 임상 1상에 진입했다.
조절 T세포 제거(Treg depletion)
종양미세환경(Tumor microenvironment)은 조절 T세포(regulatory T cells, Tregs)의 발현이 많고 이들은 면역 반응을 억제하여 항종양효과를 떨어뜨린다. 따라서 조절 T세포를 제어하는 것은 매우 중요하다. 이와 관련하여 다양한 접근법이 있지만, 최근 산업계에서 주목하는 타깃에는 CCR8이 있다.
CCR8은 종양 침윤 조절 T세포(tumor infiltrating Tregs, TITR)에 다수 발현되는 케모카인 수용체(chemokine receptor)이다. 항CCR8 항체의 항체 의존 세포 독성(Antibody-dependent cell-mediated cytotoxicity, ADCC)를 통해 CCR8+ 조절 T세포를 제거할 수 있다면, 종양미세환경 내 면역 억제 환경을 개선할 수 있을 것이다.
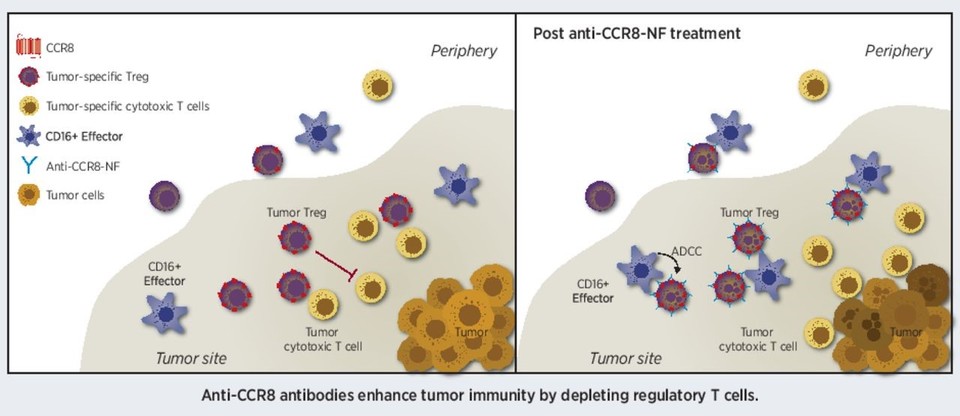
빅파마 중에는 BMS가 개발 중(BMS-986340)이고 작년 길리어드는 자운스 테라퓨틱스(Jounce Therapeutics)에서 항CCR8 항체를 도입했다(JTX-1811). 이외에도 암젠이 인수한 파이프 프라임(Five Prime)도 후보물질(FPA157)이 있다. 효과적인 조절 T세포 제거는 항체 의존 세포 독성(ADCC)을 통해 이루어지는 바, 항체 엔지니어링을 통해 ADCC 능력을 향상시키는 것이 중요한 과제이다.
이러한 접근법은 항CTLA4 항체에도 적용된다. 항CTLA 항체는 수년 전 승인받은 BMS 여보이(Ipilimumab)가 있고 몇몇 암종에서 항PD-1 병용요법으로 투여한다. 그런데 본래 이 약물에게 기대했던 작용기전에는 조절 T세포 제거도 있었다(전임상 데이터 근거).
하지만, 휴먼 임상 데이터에서는 조절 T세포의 제거 능력이 확인되지 않았고(Anu Sharma et al., 2019) BMS를 비롯한 일부 회사(e.g. Cytomx, Xilio, Adagene)는 ADCC가 향상된 항CTLA 항체로 개발 중이다. 항CTLA-4의 효능 향상뿐만 아니라, 특유의 면역 관련 부작용(Immune-related adverse events, irAE)을 완화하기 위해 ‘조건부 활성’을 유도하기도 한다(e.g. BioAtla, Chugai).
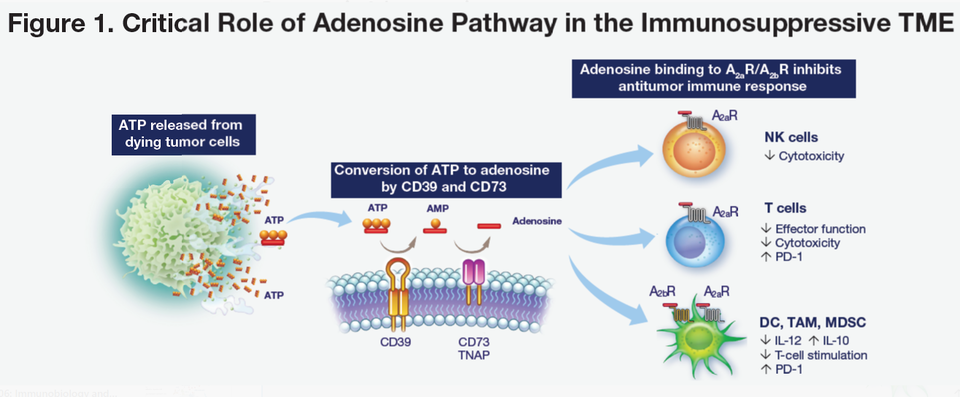
아데노신(Adenosine) 축: CD39 - CD73 - A2AR/A2BR
아데노신 축도 면역 억제 환경을 개선할 수 있는 주요 타깃으로 각광받고 있다. ATP-AMP-Adenosine-A2AR/A2BR로 이어지는 경로에서 아데노신과 A2AR/A2BR이 결합하면, 항종양 면역 반응이 감소하는 것으로 알려져 있다. 이를 극복하기 위해 ATP → AMP를 유도하는 CD39, AMP → 아데노신을 유도하는 CD73, 아데노신과 결합하는 수용체인 A2AR/A2BR을 타깃팅하는 약물이 개발되고 있다. 이 분야는 아스트라제네카가 주도한다.
새로운 면역 자극 경로 탐색
T cell engager, NK cell engager
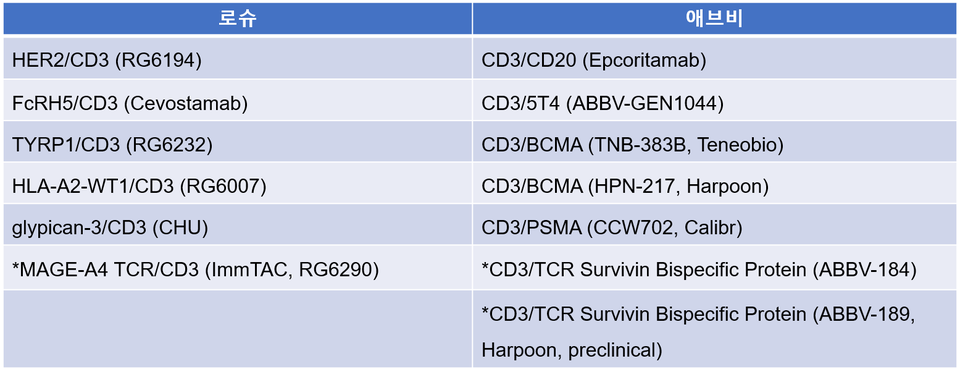
이 분야에는 여러 접근법이 있지만, 가장 눈에 띄는 것은 로슈와 애브비가 주도하는 이중항체 t cell engager이다.
T세포 공동 수용체 CD3 혹은 T세포 공동 자극 분자 4-1BB(CD137)를 통해 T세포를 활성화시키되, 종양세포 표면에 발현되는 암 항원을 타깃팅하여 면역 세포와 종양 세포를 이어주는 '브릿지' 역할을 한다.
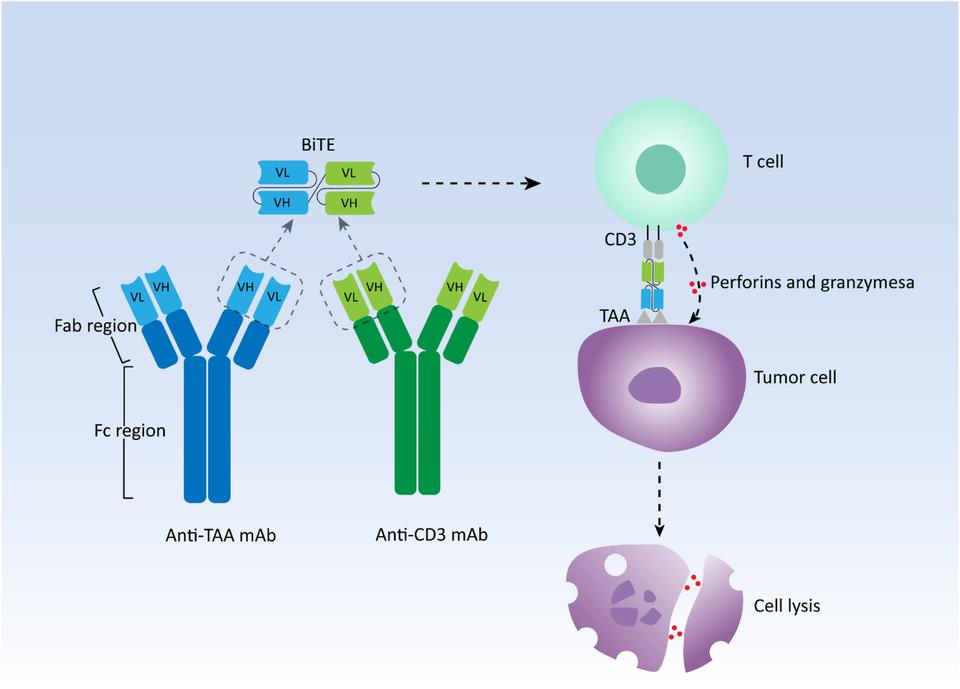
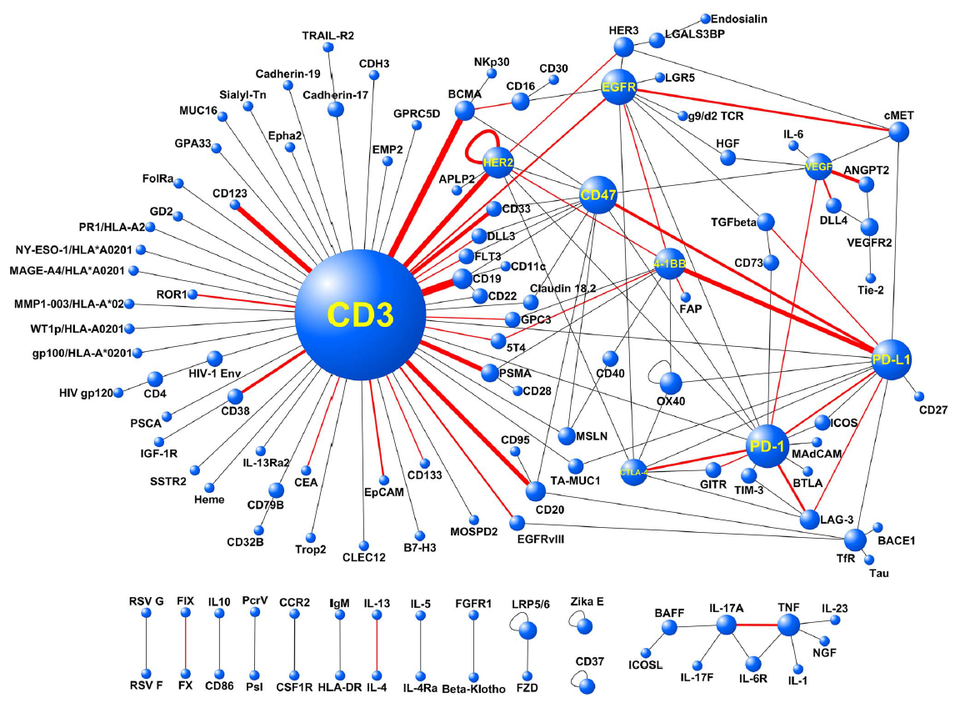
연구, 개발 흐름은 CD3 기반 T cell engager가 압도적으로 많다. 하지만 최근에는 4-1BB 기반 T cell engager도 점점 증가하고 있다. CD3는 특유의 강한 힘(potency) 때문에 약물의 활성을 제어하는 것이 어렵고 사이토카인 방출 증후군(Cytokine release syndrome, CRS)이 빈번하게 발생한다. 이 문제 때문에 암젠의 바이트(BiTE)도 임상에서 상당한 어려움을 겪었다. 지난 7월 암젠은 이를 타계하기 위해 테네오바이오(Teneobio)를 인수(CD3 low affinity)하여 새로운 길을 모색하고 있다.
2020년 6월, 애브비는 젠맙(Genmab)과 거래를 통해 다수의 CD3 T cell engager 물질을 도입했다. 젠맙의 DuoBody™ 플랫폼에서 나온 T cell engager는 상대적으로 사이토카인 방출 증후군이 덜한 편이다. 그 이유는 무엇일까? 예컨대, 이들의 엡코리타맙(Epcoritamab, bispecific CD3ⅩCD20)은 경쟁 약물과 달리 ‘피하 주사 제형’이다. 피하 투여는 약물 흡수가 천천히 되고 낮은 Cmax를 보이는 바, 이러한 요인이 사이토카인 방출 증후군 완화에 기여했을 수 있다.

CD3의 강한 힘를 제어하기 위해 테네오바이오처럼 낮은 친화도 CD3로 접근할 수도 있지만, 강한 힘은 그대로 활용하되 종양 세포에 특이적으로 작용하는 프로드럭(prodrug) 컨셉도 존재한다. 최근 다수의 바이오텍이 이러한 접근법으로 연구개발을 하고 있다. 흥미로운 것은 T cell engager에 무심했던 머크(MSD)가 이 계열의 자눅스(Janux)와 공동 연구를 시작했고 마버릭(Marverick)은 다케다, 레비토프(Revitope)는 얀센과 함께 공동 연구를 한다. T cell engager 관련 빅파마의 관심사를 엿볼 수 있다.
예컨대 ADC에서도 다이이찌산쿄의 엔허투(Enhertu)와 길리어드의 트로델비(Trodelvy)가 상용화에 성공하면서 ‘순한맛’ 페이로드가 각광받고 있지만, ‘매운맛’ 페이로드(e.g. PBD)를 프로드럭 컨셉으로 활용하는 움직임도 활발하다. 대표적으로 국내 레고켐바이오사이언스와 ADC 테라퓨틱스(중국 Adagene의 SAFEbody ™ 적용)가 있다.
애브비와 젠맙의 거래는 이중항체뿐만 아니라, ADC로의 확장 가능성까지 염두에 두고 있다. 더불어 이 거래에는 젠맙의 상용화 의지도 잘 투영되어 있다. 젠맙의 비즈니스 변화는 라이센싱 위주의 바이오텍이 성장기를 경험한 후, 어떠한 상용화 전략을 구사하는지 잘 보여준다.
지난 2012년 얀센과 젠맙은 DuoBody™ 플랫폼 관련 거래를 했고 현재 다수의 후보물질이 임상에 진입했다. 다발성 골수종(Mutiple myeloma)에서 유망한 데이터를 도출한 탈케타맙(Talquetamab, GPRC5D/CD3), 테클리스타맙(Teclistamab, BCMA/CD3)은 경쟁 약물 대비 경쟁력과 차별성이 있다.
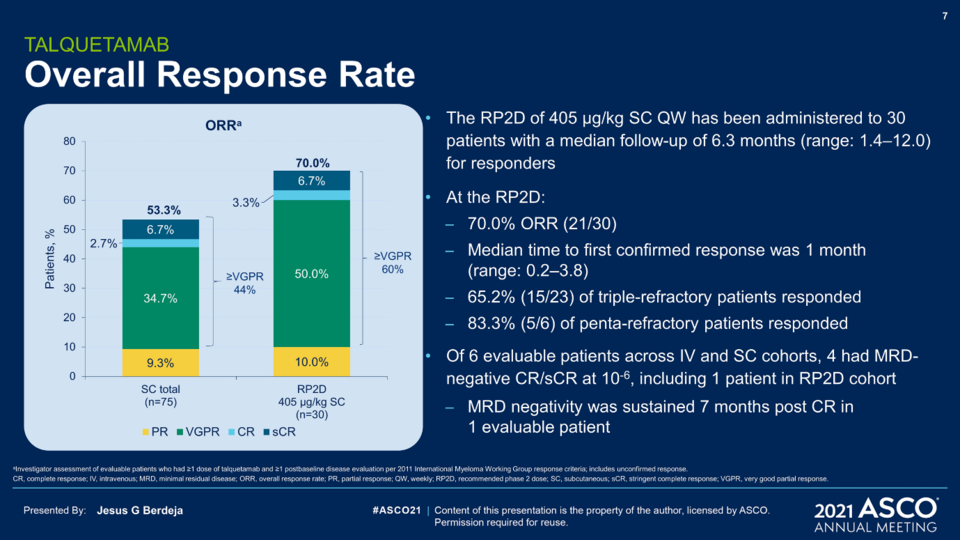
다발성 골수종 이야기가 나온 김에 이 분야의 전반적인 지형을 소개하겠다.
다발성 골수종은 이 분야의 ‘황제’격인 BMS가 있다. 다발성 골수종 약물 중, 전세계에서 가장 많은 매출액을 올리는 면역 조절 이미드 계열 약물(Immunomodulatory imide drugs, IMiDs) 레날리도마이드(Lenalidomide)가 있고 차세대 IMiD도 임상에 진입했다. 또한 다발성 골수종에서 가장 유명한 타깃인 BCMA는 다양한 모달리티에 적용하여 임상 중이다.
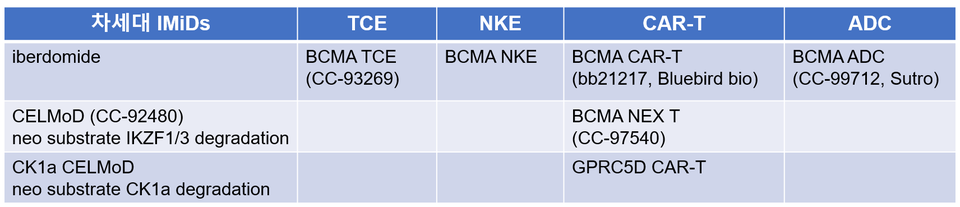
얀센과 사노피도 다발성 골수종에 대한 깊은 관심이 있고 활발한 임상 개발을 하고 있다. 두 회사는 항CD38 항체를 상용화했고(daratumumab, isatuximab) 지금은 항CD38의 업그레이드 버전을 개발 중이다. 예컨대 사노피는 항CD38 항체 Fc 엔지니어링 버전과 항CD38/CD28/CD3 삼중항체 가 임상 1상에 있다. 제어하기 쉽지 않은 공동 자극 분자인 CD28과 CD3을 함께 활용하는 흥미로운 접근법이다.
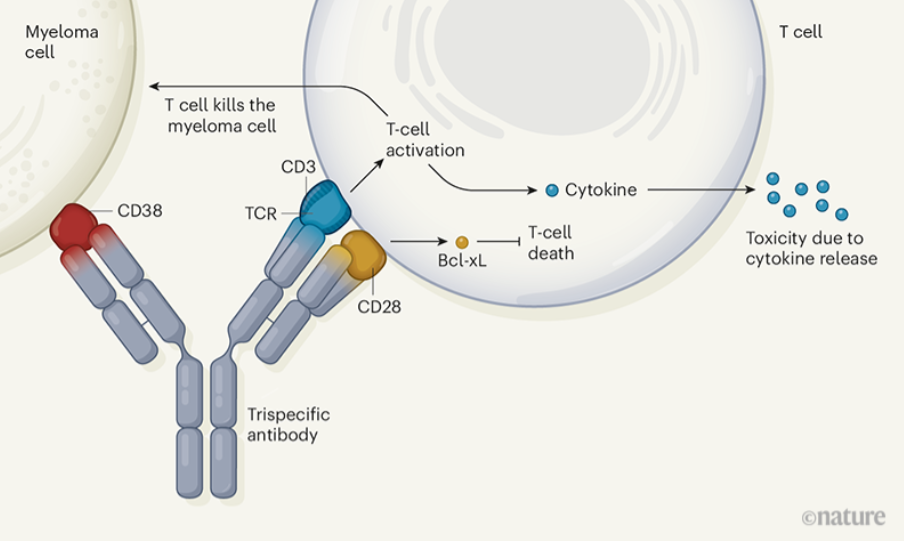
지금까지 CD3 기반 T cell engager를 논의했다면, 다른 공동 자극 분자를 활용하는 연구에 대해서도 간략히 언급하겠다. 4-1BB는 과거 BMS와 화이자가 작용제(agonistic) 단클론항체로 개발했다가 특유의 간독성과 효능 부족 때문에 진전되지 못한 경험이 있다. 후발 주자들은 이를 극복하기 위해 다양한 시도를 하고 있다.
T cell engager로 개발하는 회사(젠맙/바이온텍, 피어리스, 에이비엘바이오 등)가 많다. 그리고 로슈 자회사인 일본 주가이 제약(Chugai)처럼 종양미세환경의 특수한 성질(extracellular ATP 상승)을 이용하여 종양 세포에서만 특이적으로 작용하는 접근법도 있다(CD137 switch antibody, STA551, 임상 1상 진입).
아직 빅파마라고 할 순 없지만, T cell engager 관련 리제네론(Regeneron)의 행보도 살펴볼 만하다. 이들은 15년 전 임상 실패 후, 한동안 봉인되었던 CD28을 수면 위로 올렸다. CD28은 리간드 CD80/86과 상호작용하여 T세포 활성화를 유도하는 T세포 공동 자극 분자이다.
T cell engager뿐만 아니라, NK cell engager도 활발히 연구, 개발 중이다. NK 세포 표면에 있는 활성 수용체(e.g. CD16, NKG2D)와 종양 세포의 특정 항원을 연결하는 개념이다. 이 분야에서 눈에 띄는 회사는 드래곤플라이 테라퓨틱스(Dragonfly Therapeutic)인데 머크(MSD), BMS, 애브비와 다양한 공동 연구를 진행하고 있다.
NK세포, T세포는 우리 몸이 암세포를 사멸하는 과정에서 매우 중요한 면역 세포이다. 그러나 여러가지 원인에 의해 억제되면, 충분한 항종양효과를 발휘하지 못한다. T cell engager의 역할은 면역 세포가 종양 특이적, 선택적으로 활성화될 수 있도록 종양 세포와의 연결 고리를 만드는 것이다. 문제는 활성 경로를 아무리 자극하더라도 억제 경로가 잔존한다면, 효과적인 치료 효과를 기대하기 어려울 것이다. 따라서 자극 경로와 억제 경로를 고루 타깃팅하는 것이 필요할 수 있을 것이다.


