희귀의약품, 우선심사, 가속승인, 패스트트랙, 혁신신약 지정의 의미
"FDA 신속 승인 위해 환자 집단 선정과 표준치료 비교 데이터 갖춰야"
'B 회사는 최근 미국 식품의약국(FDA)이 신약후보물질 b를 희귀의약품(orphan drug)으로 지정했다고 00일 밝혔다.'
'A 회사는 최근 미국 식품의약국(FDA)이 신약후보물질 a를 혁신신약(Breakthrough Therapy)으로 지정했다고 00일 밝혔다.'
국내에서 신약개발을 하고 있는 회사들로부터 위 같은 내용을 담고 있는 보도자료를 종종 받습니다. 더 정확히 말하자면, 희귀의약품으로 지정됐다는 소식을 혁신신약 지정보다는 더 잦은 빈도로 소식을 공유 받습니다.
신약개발 규제과학을 주도하는 FDA가 지정하는 것이니, 희귀의약품이나 혁신신약 모두 그 약물의 가치를 인정받는 것이지 않을까 막연히 생각하며 독자 여러분들께 해당 소식을 회사의 보도자료 그대로 전달했습니다.
그러다 업계 관계자 분 중 한분이 FDA의 혁신신약 지정(Breakthrough Therapy Designation; BTD)은 향후 기술이전 시 좋은 자료로 인정받을 수 있는 중요한 지표이며, 해당 약물의 개발 가치를 인정해 주는 것이라는 의견을 주셨습니다.
히트뉴스는 항암제 개발 규제과학 전문가의 자문을 바탕으로 △희귀의약품 지정(Orphan Drug Designation; ODD) △혁신신약(Breakthrough Therapy; BTD) △패스트 트랙(Fast Track) △우선 심사(Priority review) △가속 승인(Accelerated Approval) 이 갖는 의미를 살펴봤습니다. 이후 국내 신약개발 회사들이 이 제도를 어떻게 활용하면 좋을지 전문가 자문을 전합니다.

#1. FDA의 ODD로 신약 후보물질의 가치를 매길 수 있을까?
희귀의약품으로 지정(ODD) 받으려면, 해당 질환이 환자 수가 적고, 미충족 의료수요가 높아야 합니다. 통상 환자 수가 10만명 이하면 신약 개발 회사가 ODD를 시행해 볼 수 있습니다. ODD의 혜택은 △연구개발 비용의 25%(임상 비용의 50%) 세액 공제 △시판 후 7년 시장독점권 부여 혜택 등을 받을 수있습니다.
항암제 개발 규제과학 전문가는 미국 신약개발 회사들은 환자 수만 충족하면 통상적으로 ODD 절차를 진행한다고 말합니다. 특히 ODD는 의약품품목허가신청(NDA)와 직접적인 연관성은 없다고 설명합니다.
"미국 제약회사의 경우 10만명 이하 질환 관련 약제를 개발할 때, 통상적으로 ODD로 지정을 받습니다. 웬만한 항암제의 경우 ODD를 시도하고, 끝까지 개발할 의지가 있는 약제는 기본적으로 ODD로 지정을 받습니다.
특히 7년 시장독점권의 경우 개발에서 매우 중요한 혜택이 될 수 있습니다. ODD는 NDA와 직접 연관이 돼 있는 것이 아니고, 신속심사 프로그램(Expedited. Programs)에 속한 것으로 인허가를 빠르게 하는 제도입니다."
정리를 해 보면, ODD는 신약개발 단계에서 연구를 위한 세제 혜택을 얻을 수 있습니다. 또한 시판 후 시장독점권을 얻을 수 있습니다. 하지만 ODD는 해당 신약 후보물질의 연구 데이터가 아닌 단순 질환의 환자 수로 지정됩니다. 때문에 ODD는 해당 신약 후보물질의 신약가치를 입증하는 것은 아니라는 것입니다.
#2. 패스트트랙과 혁신신약 지정이 가지는 의미
-비임상과 임상 데이터 보유 차이
신속심사 프로그램(Expedited. Programs)은 △패스트 트랙(Fast Track) △혁신신약(Breakthrough Therapy; BTD) △우선 심사(Priority review) △가속 승인(Accelerated Approval)으로 분류됩니다.
패스트트랙은 심각한 질환(Serious Condition)의 치료가 가능하고, 의학적 미충족 수요(Unmet Medical Need)의 해결 가능성이 있는 신약에 지정되는 프로그램입니다. 의학적 미충족 수요의 해결 가능성이 있는 의약품의 조건은 다음과 같습니다.
△기존 치료법이 없거나 △기존 치료법의 약효가 부족한 경우에 효과가 있거나 △기존 치료법에 반응하지 않는 경우에 효과가 있거나 △기존 치료제와 병용해 효과적 사용이 가능하거나 △기존치료제 대비 독성 및 약물의 상호작용의 가능성을 줄이거나 △기존치료제 대비 복약순응도를 개선해 심각한 상태를 개선하거나 △공급중단 등의 이슈를 해결할 수 있는 조건 등을 갖춰야 합니다.
패스트트랙의 경우 비임상 자료(non clinical data)를 통해서 해당 신약의 기전이 혁신신약(first in class) 수준이어야 하고, BTD는 임상 1/2상의 자료가 확보돼 있어야 합니다. 때문에 국내 제약회사들 중에서 미충족 의료 수요 조건을 충족하는 혁신신약(first in class) 수준의 비임상 데이터가 있으면 패스트 트랙 지정을 고려해 볼 수 있습니다. 이에 대한 전문가의 설명은 다음과 같습니다.
"신약 개발 회사들은 비임상 데이터가 혁신신약(first in class) 수준으로 아주 뛰어나면(outstanding), 일단 패스트 트랙 지정을 고려해 볼 수 있습니다. 이후 임상에서도 이와 같은 데이터의 우수성이 유지되면 BTD 지정까지 고려해 볼 수 있습니다. 만약 레이저티닙 앞에 타그리소가 없었다면 패스트트랙과 BTD 지정을 고려해 볼 수 있었을 것입니다."
실제로 레이저티닙(렉라자)보다 앞서 개발된 타그리소(오시머티닙)의 경우 패스트트랙을 지정 받은 뒤, BTD를 받고 우선심사와 가속승인까지 받을 수 있었습니다. 물론 BTD가 항상 우선심사와 가속승인을 보장하는 것은 아니지만, BTD는 가속승인의 가능성의 지표로는 볼 수 있습니다. 이에 대한 전문가 설명은 이렇습니다.
"대부분 임상 2상의 데이터에서 대리평가지수(surrogate endpoint)를 토대로 BTD를 지정 받습니다. 즉 BTD는 패스트트랙의 비임상 데이터를, 임상에서도 유의미하다는 것을 증명한 것입니다.
BTD는 임상 데이터를 확보한 것이기 때문에 일정 부분 가속승인에 대한 약속을 받은 것입니다. 즉, BTD로 가속승인을 100% 받을 수 없지만, 특별한 이슈가 없는 한 우선심사까지는 통상적으로 무난하게 이어집니다."
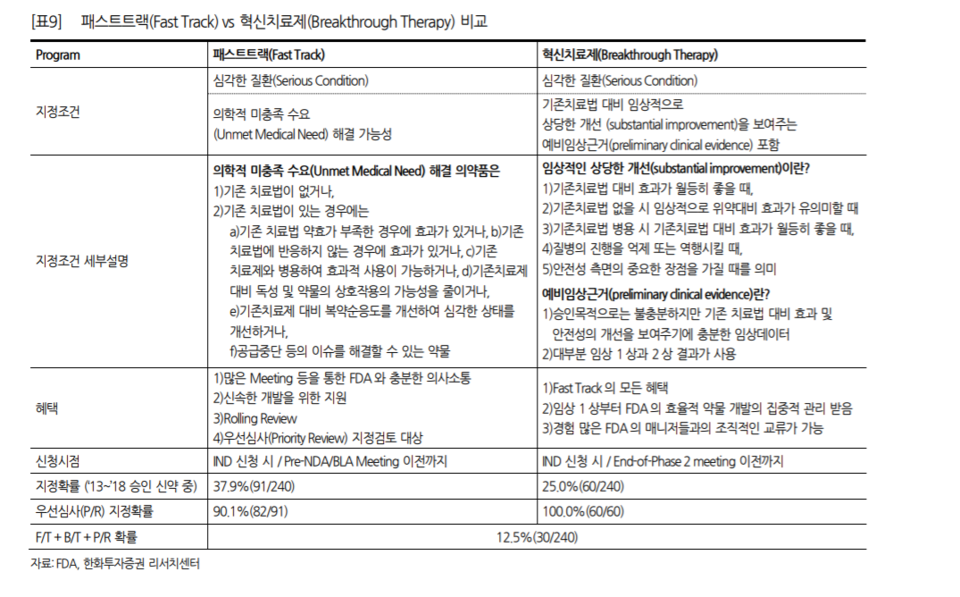
NDA를 받기 위한 절차에서 FDA의 심사를 거쳐야 합니다. 우선심사 대상이 되면 기존 360일에서 140일까지 단축할 수 있습니다. 가속화 승인은 임상 2상 정도의 자료에서 기존 치료제 대비 매우 우수한 데이터가 확보돼야 합니다.
#3. BTD 받으려면 꼭 혁신신약 이어야 할까?
그렇다면 임상 데이터를 토대로 FDA로부터 일정 정도 약물의 가치를 입증 받을 수 있는 BTD를 받기 위해선 꼭 혁신신약 이어야 할까요? 결론부터 말하자면 꼭 그렇지는 않습니다. 제줄라(니라파립)가 전립선암 적응증에 대해서 BTD를 받은 사례가 있습니다.
니라파립의 경우 앞서 난소암과 유방암에 대해서 이미 적응증을 획득한 약물입니다. 같은 기전으로 이미 아스트라제네카의 린파자(올라파립)가 있기 때문에 난소암과 유방암에서는 혁신신약(first in class)이라고 볼 수 없습니다.
그러나 BRCA1/2 유전자 변이 전이성 거세저항성 전립선암에서는 미충족 의료수요가 인정돼, BTD를 받을 수 있었던 것입니다. 다시 말해 니라파립이 전립선암 전체 환자에서는 BTD 지정을 받을 수 없지만, BRCA1/2 유전자 변이를 가진 것에 대해서는 BTD를 받을 수 있는 것입니다.
이를 통해 BTD는 단순히 질환, 약물을 기준으로 정하는 것이 아니라, 질병, 약물, 치료 성적 등의 총체적인 것으로 결정된 다는 것을 알 수 있습니다.
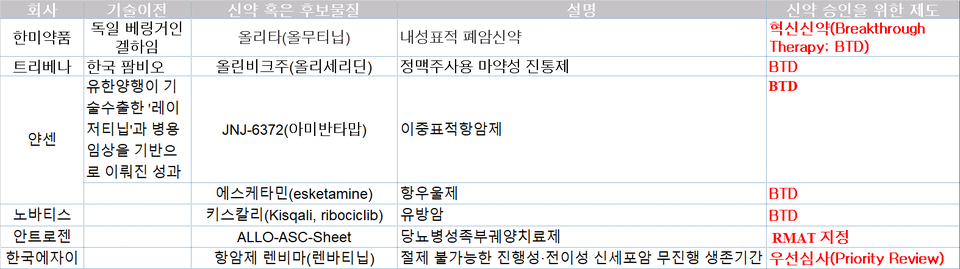
#4. 국내 신약개발 회사 패스트트랙 이후 BTD로 넘어가야
아쉽게도 국내 신약개발 회사가 개발한 신약후보 물질 중 BTD를 받은 사례는 거의 없습니다. 지난 2015년 한미약품이 개발한 올리타(개발명 HM61713)가 지정받은 것 외에는 말입니다. 때문에 국내 제약회사가 개발한 신약 후보물질 중 BTD를 받는 게 있다면 이는 빅파마의 기술이전 가능성도 점쳐 볼 수 있다고 볼 수 있습니다.
"BTD는 우선심사가 거의 보증되는 것입니다. 사실상 BTD를 지정 받은 신약 후보물질의 경우 매우 높은 가치를 받아 기술이전을 하거나 개발을 자체적으로 더 진행해 높은 가치로 기술이전을 할 수 있을 것입니다.
국내 제약회사들은 일단 (비임상 데이터를 토대로 한) 패스트트랙 지정을 염두에 두고, BTD까지 고려해야 합니다. 최근 실시간종양학리뷰(Real Time Oncololgy Review)가 생겨, 일단 BTD를 받으면 임상 IND 중에도 리뷰를 이어가 실상 심사 과정도 180일이 채 걸리지 않습니다."
끝으로 이 전문가는 국내 신약개발 회사가 BTD 등 FDA의 신속심사 프로그램을 적절히 활용하려면 △언메니즈 △표준치료에 대한 정확한 이해가 필요하다고 조언합니다.
"제줄라와 같은 사례처럼 온콜로지스트가 생각하는 명확한 미충족 의료수요를 알아야합니다. 단순 질환명이 아니라 새로운 유전형에 따른 총제적 개념의 미충족의료 수요를 알아야 합니다.
또한 해당 질환에 대한 표준치료 대비 우위를 명확히 데이터로 입증해야 합니다. 특히 비임상 연구를 많이 하는 국내 제약회사는 비임상 단계부터 negative control과 positive control에 대한 데이터를 모두 갖고 있어야 합니다. 생각보다 기존 표준치료 대비 우위를 나태내는 positive control 비임상 데이터를 갖추지 못한 곳도 종종 볼 수 있습니다.
패스트트랙 지정을 위해선 비임상 동물실험 데이터에서 약물작용기전(MOA) 뿐만 아니라 표준치료와 비교한 데이터 등을 모두 잘 갖춰야 합니다. 이를 토대로 임상 환자 군(population)을 잘 지정하고, 임상 디자인을 잘 설계해 BTD 지정까지 고려해야 하는 것입니다."

