경구 HIF-2α 억제제 벨주티판, 키트루다+렌비마와 병합
지아이이노베이션 이중융합 GI-101, 임상 1·2상 IND 승인
화이트 생명과학 사포그렐SR, 우판권 기간 어겨 허가취소
한눈에 보는 임상 승인·품목 허가 - 4월 4주(04.19~23)

약 90%의 신세포암 환자들은 'VHL(본히펠린다우)'라는 단백질에 결손을 보여 암 진행을 가속한다는 연구가 있었다. 이에 따른 'HIF-2α 표적항암제'는 임상 3상을 승인받아 키트루다 및 렌비마 병용요법과 비교에 나선다.
지아이이노베이션은 면역관문 억제 효과와 면역세포 증식 효과를 동시에 나타내는 이중융합 항암 후보물질로 1/2상 시험계획(IND)을 승인받았다. 화이트생명과학의 항응고제 '사포그렐SR정'은 우선 판매 품목허가에 따른 판매금지 기간에 시판한 사실로 허가 취소됐다.
엠에스디, 계열 최초의 약물로 '벨주티판' 3상 박차
대원제약 복합 이상 지질 겨냥 'DW-4301' 2상 진입
히트뉴스(www.hitnews.co.kr)가 식품의약품안전처 4월 4주(19~23일) 임상시험 현황 집계 결과 총 27건이 승인됐다. 각각 △제네릭 허가를 위한 생동 12건 △신약 개발·도입·허가 7건 △학술 연구용 4건 △복합제 개발과 효능효과 확인·추가 3건 순이다.
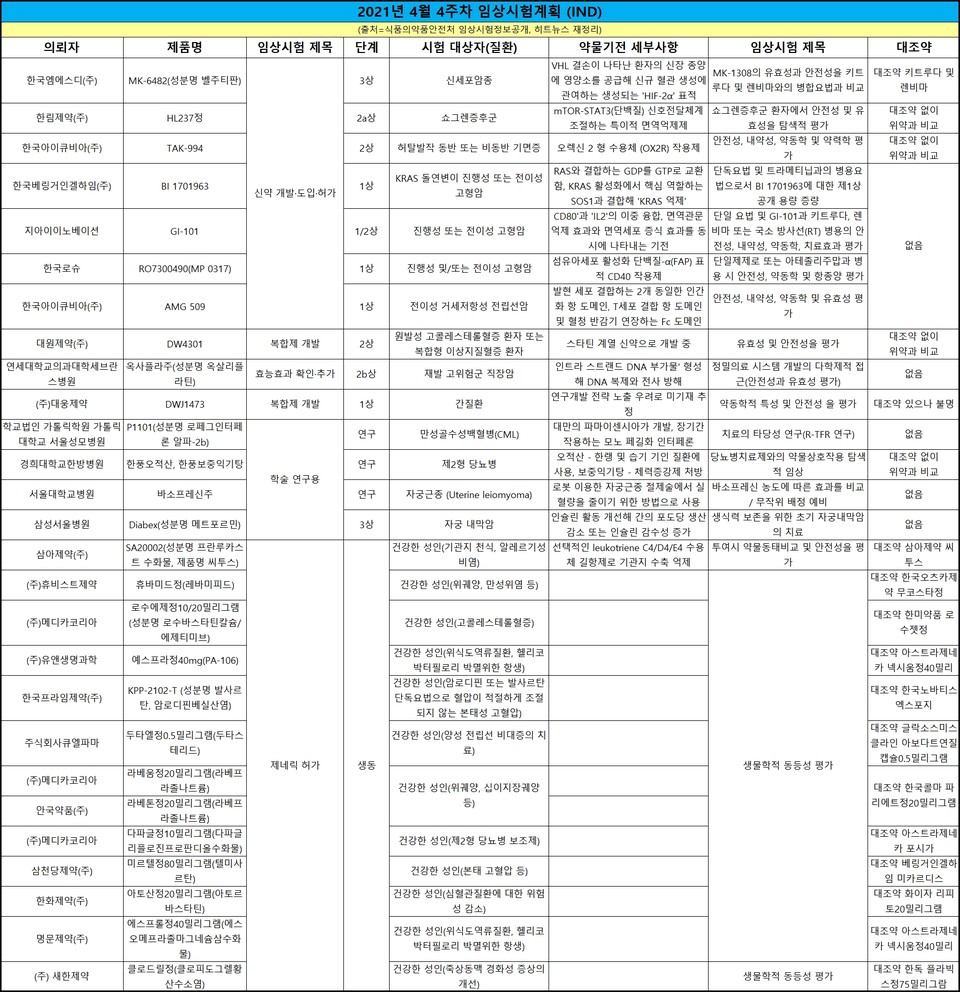

한국엠에스디는 표적 항암 후보물질 MK-6482(성분명 벨주티판)을 진행성 신세포암 1차 치료제로 임상 3상에 나선다.
MK-6482와 렌비마(성분명 렌바티닙)의 병합요법으로 투여한 키트루다, 렌비마와의 병합요법으로 투여한 MK-6482를 비교한다.
벨주티판은 지난 2019년 다나파버 암 연구소가 '본 히펠린다우(VHL) 단백결손'이 암 발생에 관여한다는 기전으로 개발한 물질이다. VHL 결손이 나타난 환자의 신장 종양에 영양소를 공급, 신규 혈관 생성에 관여하는 'HIF-2α'를 집중 표적 하는 물질이다.
연구소와 엠에스디가 공동 개발 중인데 앞서 표적항암제나 면역억제제를 사용해도 효과 없던 환자들에서 벨주티판은 24%의 반응률을 이끌었다. 벨주티판은 경구용 'HIF-2α' 억제제 계열 중 최초 치료제(First-in class)다.
한국엠에스디는 지난해 2월 과거 PD-1/L1 및 VEGF 표적 요법 이후 질병 진행을 경험한 신세포암 환자 대상으로 MK-6842를 에베롤리무스와 비교하는 임상 3상을 승인받았었다. 2025년 9월까지 736명 글로벌 환자를 등록시키고, 국내에서는 22명이 참여할 예정이다.

지아이이노베이션은 지난 21일 면역 항암 후보물질 'GI-101' 단일 요법과 GI-101 및 키트루다, 렌비마 또는 국소 방사선(RT) 병용 임상 1·2상 시험계획을 승인받았다.
GI-101은 면역관문억제제와 사이토카인이 이중융합 형태로 결합한 후보물질이다.
고영준 디스커버리 부문장은 히트뉴스에 "사이토카인의 경우 항암효과를 기대할 수 있지만, 부작용이 크다. 부작용을 줄이면서, 효과를 높이려 IL-2 변이체를 붙였다"고 설명했었다. 회사는 지난 2019년 중국 심시어와 GI-101의 현지 판권 이전 계약을 체결했고, 글로벌 판권 기술이전 기회는 남아있다는 입장이다.
윤나리 임상개발팀 이사도 히트뉴스와 인터뷰에서 "암 환자의 생존율 개선을 위해 면역반응을 올려줄 다양한 약제와 GI-101을 병용, 최대한의 임상적 효능을 보이는 게 목표"라고 말한 바 있다. 회사는 이 임상을 MSD와 함께 진행한다.
대원제약이 원발성 고콜레스테롤혈증 또는 복합형 이상지질혈증 환자를 겨냥한 'DW4301'의 개발에 박차를 가하고 있다. 이들을 대상으로 유효성과 안전성을 평가할 수 있는 임상 2상을 승인받았다.
회사는 2014년 11월 인도 소재 글로벌 제약사 Sun Pharma에게 이 물질을 도입해왔고 2009년 이후 첫 '스타틴 계열 신약'을 목표로 개발하고 있다. 다만 회사는 어떤 조합과 기전의 물질인지에 대해 "미발매 제품 전략 등 노출의 우려로 공개할 수 없다"는 입장이다.
환인제약 파킨슨 치료 '프라미펙솔 시장' 진입 준비
위임형 후발사들 고배 마신 '텔미-로수'에 제네릭 출현
4월 4주 허가 현황에 따르면 총 46품목이 허가받았지만 49품목은 취하했다. 이 가운데 허가취소 처분을 받은 항혈전제가 있다.
식약처는 우선 판매 품목허가에 따른 판매금지 기간에 의약품을 판매한 화이트생명과학의 사르포그렐레이트염산염 성분 '사포그렐SR정' 허가를 23일 자로 취소했다. 사르포그렐레이트염산염 서방정의 경우 지난 2019년 5월 29일 22품목이 우판권을 획득해 그해 7월 급여 적용됐다.

지난해 4월 2일까지 9개월간 우판권 가진 품목만 판매 가능했다.
의약품 시장 데이터 유비스트(UBIST)를 보면 화이트생명과학의 '사포그렐SR정'은 해당 기간 동안 처방실적이 집계되지 않았다. 하지만 도매에 유통된 정황도 판매행위로 인정돼 처분받은 것으로 보인다.
환인제약은 파킨슨병 치료제 '라미펙솔서방정(성분명 프라미펙솔)'의 고용량을 추가 허가받아 모든 용량을 확보했다. 0.75mg와 1.5mg 제제를 갖게 된 환인제약은 '프라미펙솔 시장' 진입을 준비하고 있다.
오리지널은 베링거의 미라펙스서방정이며 환인제약은 지난해 8월 미라펙스의 제형 특허, 용도특허에 소극적 권리 범위를 청구해 승소한 바 있다. 이후 회사는 0.375mg을 허가받은 이후 순차적으로 품목군을 구축했다.
베링거의 미라펙스서방정 외에도 현대약품 미라프서방정과 삼일제약 프라펙솔서방정 등이 허가받고 시장에 발매되고 있다. 지난해 처방실적은 미라펙스서방정이 19억 원, 미라프서방정과 프라펙솔서방정이 각각 7억 원으로 오리지널과 제네릭 군의 실적이 비등했다.

'텔미사르탄과 로수바스타틴 조합'의 고혈압-이상지질혈증 복합제 위임형 후발 약이 시장에서 고전하는 가운데 위더스제약이 제네릭을 허가받았다.
위더스제약의 브랜드는 '듀로텔'로 위탁 제네릭은 추가 확인되지 않았다.
지난해 10월 30일 오리지널인 듀오웰의 PMS(재심사) 만료되기 전 일동제약 텔로스톱과 일동제약의 위임형 후발사들만으로 총 20개 품목이 등재됐었다. 이 가운데 올해 2월부터 콜마파마, 종근당 등이 제네릭 허가를 받았고 계단식 약가제도에 의해 600원대의 약가를 받는다.
하지만 2제 복합제 처방실적이 전반적으로 하락세에 접어든 데다 위임형 후발사들이 영업·마케팅 역량을 못 갖춘 채 진입해 실적 부진을 겪고 있다. 올해 허가받고 시장에 진입할 제네릭들이 어떤 성적을 보일지는 지켜봐야 할 일이다.

