식약처, 온라인 설명회서 완제중심 허가·심사방안 설명
최초등록 DMF, 1년만에 35% 자진취하 "전주기 관리필요"
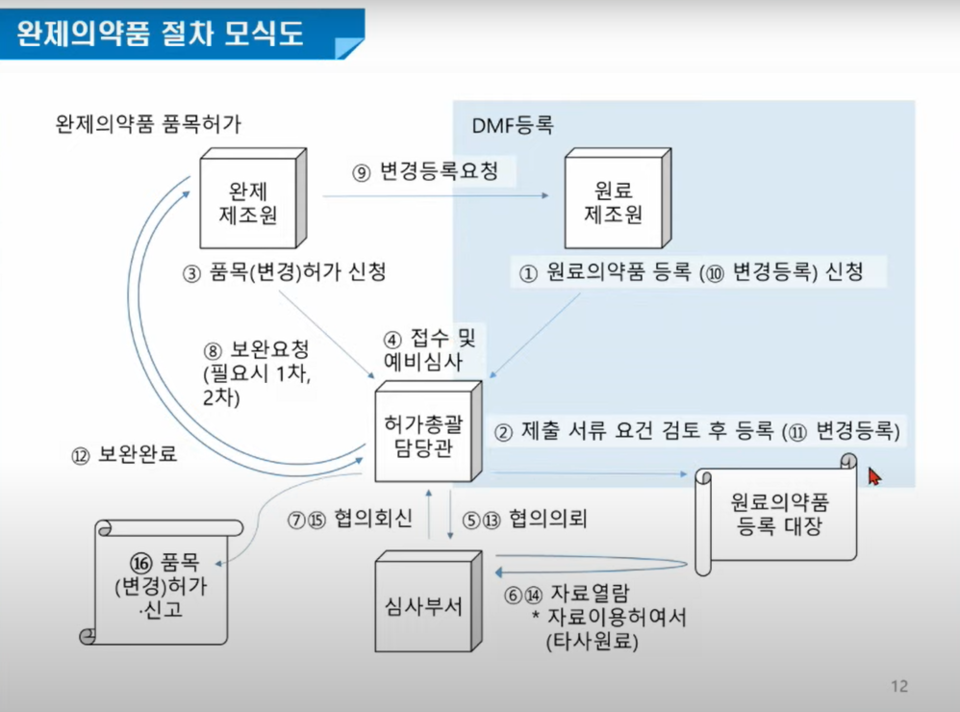
원료의약품과 완제의약품 연계 허가심사가 시행되는 가운데, 기허가 완제약 원료의 DMF 등록은 인정된다. 단, 변경허가 시에는 원료약과 완제약 연계심사를 진행하게 된다.
식품의약품안전처 도원임 허가총괄담당관실 연구관은 12일 진행한 '2021년 의약품 허가업무 온라인 설명회'에서 "기허가 완제의 원료는 종전 완제허가에 따라 처리했으니 DMF 등록 인정된 것"이라고 밝혔다.
그는 이어 "주성분이나 제조방 변경 등 완제의 품질에 영향이 있을 만한 변경허가 때는 원료도 검토해 심사할 예정"이라고 부연했다.
앞서 업계와 가진 간담회에서는 기허가 완제약 원료도 포함해 손을 보겠다고 했으나, 기준을 다소 완화시킨 것이다. 즉, 앞으로 변경 허가, 신규 허가 시에 원료약과 완제약 연계심사가 진행된다. 이에 따른 종합적인 품질관리는 완제약 제조사가 책임을 진다.
또한 GMP 실태조사 미실시 대상 원료의약품 등록 처리기한이 종전 120일에서 20일로 단축된다.
원료약 자료는 국제공통기술문서(CTD)로 전자민원시스템(의약품안전나라)에 등록하면 된다. 식약처는 GMP 실태조사를 하지 않고 적합성만 따지기 때문에 처리기한이 120일에서 20일로 단축 가능하다.
도 연구관은 "만일 해당 원료약을 사용하는 완제약 품목이 없다면 사전등록을 하지 않아도 된다"며 "원료약 제조사는 완제약 제조사에 자료이용 허여서를 발행하면 된다. 식약처는 자료 보완이 필요한 경우, 완제약 허가(신고) 신청자에 요청할 예정"이라고 했다.

DMF 등록여부는 의약품안전나라에서 품목 검색만 하면 볼 수 있다. 식약처는 등록된 사항을 공개할 때 ▲최종버전 ▲변경이력 ▲완제약 ▲당해연도 연차보고 여부 등을 포함한다.
수입 원료로 완제약 품목 허가를 받으려는 업체도 따로 DMF 등록할 필요없이 원료 등록자나 제조자로부터 '자료이용 허여서'를 받아 DMF 등록하면 된다. 완제 기준 및 시험방법에 대해 사전검토를 요청할 때 원료 연계심사 가능하다.
도 연구관은 "완제 업체에 원료 업체의 책임을 일부 부여해 전주기 안전관리를 강화하려는 취지"라며 "완제의 안전성·유효성 입증 자료와 균일한 효능을 보장할 품질(원료~완제 포장까지 모든 자료)를 종합적으로 심사·평가해 허가한다"고 했다.
이어 "식약처는 지난해 5월 제네릭의약품 품질심사 절차 개선정책을 마련한 바 있다. 완제 중심으로 허가·심사 체계를 강화해 업무 효율성을 높일 것"이라고 덧붙였다.

