소아가 이야기하는 '성공적인 셀루메티닙 이야기'
MEK(MAPK/ERK)을 저해하는 항암제는, BRAF 돌연 변이가 있는 흑색종의 치료에 BRAF 저해제와 병용하였을 때 매우 좋은 효과를 보여 2014년 GSK 의 트라메티닙(trametinib)이 다브라페닙(dabrafenib)과 병용을 승인 받은 이후 ▷2015년 로슈의 코비메티닙(cobimetinib)이 베무라페닙(vemurafenib)과 병용으로 ▷2018년 Array BioPharma (Array) 의 비니메티닙(binimetinib) 이 엔코라페닙(encorafenib) 과 병용으로 각각 승인을 받았다.
특히 binimetinib과 encorafenib의 병용은 앞에 승인을 받은 병용약들에 비해 진행성 흑색종 환자들의 생존율을 현저히 개선시켜 4년이나 늦었음에도 가장 좋은 병용약제로 각광을 받고 있다. 그러나 BRAF 돌연변이가 있는 대장암에서 binimetinib은 encorafenib과 cetuximab의 병용이 보여준 임상적 이득에 비해 추가적인 이득이 증명되지 않아 새로운 적응증을 얻는데 실패했다. 이후 Array BioPharma는 화이자(Pfizer)에게 13.2 조원의 가격에 인수 합병돼 binimetinib과 encorafenib은 Pfizer 의 항암제 대열에 합류하게 되었다.
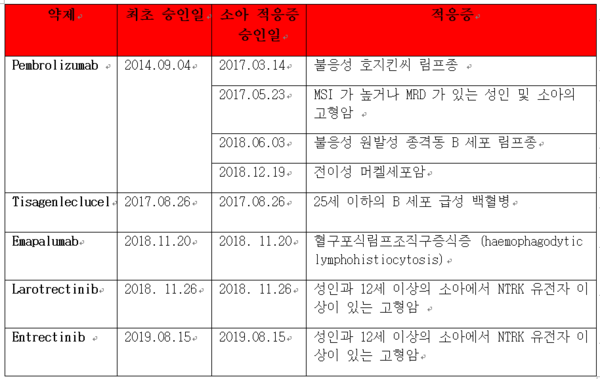
그런데 Array는 2003년 'selumetinib'이라고 하는 MEK 저해제를 아스트라제네카(Astra Zeneca ,AZ)에 라이센스 아웃한 경력이 있다. Selumetinib은 AZ 에서 비소세포 폐암과 갑상선 암의 치료를 위해 개발되고 있었으나 다른 회사들이 흑색종 적응증에 성공하는 동안 적응증 승인에는 성공하지 못하고 있었다. 한편, 미국 NCI-CTEP 이 selumetinib을 단독 또는 다른 항암제와 병용으로 뇌종양, 비소세포 폐암, 소아 신경섬유종 등 많은 임상개발 프로그램들을 운영하던 중 2세 이상의 신경섬유종 환자를 대상으로 하는 2상 임상시험에서 selumetinib 단독 치료가 매우 좋은 결과를 보임을 알게 되었다. 이를 통해 AZ 는 2019년 FDA 로부터 selumetinib의 breakthrough designation을 받게 되었으며 2020년 적응증 승인을 받게 됐다.
복잡한 이야기이지만 selumetinib 의 개발 경위에는 매우 많은 시사점이 있다.
첫째, 2003년 가장 선발로 개발된 selumetinib이 임상개발에서는 오랫동안 방황했다는 것이다.
둘째, 후발인 trametinib과 cobimetinib이 병용약제와의 개발로 성공적인 상업화를 이루는 동안에도 흑색종을 포함한 여러 암종에서 생물학적으로 가장 적절한 병용 약제를 찾지 못해 애로를 겪었다.
셋째, 그 동안 원 개발자인 Array는 보다 좋은 MEK 저해제와 BRAF 저해제를 만들어 임상 개발에서도 챔피언의 자리에 올랐다.
넷째, AZ 는 결국 회사가 아닌 NCI-CTEP의 임상연구로 소아암에서 적응증을 얻었다.
다섯째, selumetinib 의 등록 임상시험은 55명 규모의 2상 임상시험이었으나 반응률 66%, 12개월 이상 반응 지속 환자 88%의 성적으로 조건부 승인이 아닌 정식 승인을 받았다는 것이다.
최후에 웃는 자가 승자라지만 2023~2024년 사이에 특허가 만료되는 selumetinib의 승인이 AZ 에 재정적인 성공을 가져다 주지는 않을 것이다. 그러나, 소아암을 보는 의사와 소아암 환자들에게는 엄청난 성공 이야기이다. 이쯤에서 소아암에 대한 항암제 개발에 대한 이야기를 시작해 볼까 한다.
Selumetinib이 승인을 받은 것을 축하하며 미국의 소아암재단은 "제인의 성공적인 Koselugo 이야기"라는 유튜브 영상을 올렸다. 제인은 소아 신경섬유종 환자로 이쁘고 순수한 얼굴에 신경섬유종으로 한쪽 볼이 불룩하게 튀어나온 상태로 진지하게 selumetinib의 임상시험에 들어간 후 종양이 줄어들고 6년 째 자라나지 않아 자기가 얼마나 정상적인 생활을 하고 있는지를 이야기한다. 주치의는 이 약이 제인에게 가져다준 기적과 행복에 대해 설명하면서 selumetinib의 승인으로 임상시험이 아닌 진료 현장에서 약이 사용 가능하게 됨에 대한 기쁨을 이야기하고 있다. 그만큼 소아암 치료제 한 개의 승인이 우리의 희망인 어린이들에게 주는 가치는 잴 수 없을 정도로 크다는 것을 알 수 있다.
2019년까지 미국 식품의약국(FDA)이 승인한 항암제는 180개에 이르지만 소아암에 적응증을 받은 항암제는 40개가 채 되지 않는다. 여기에는 여러가지 이유가 있겠지만 환자 수가 많지 않은 소아암에 임상개발의 어렵고 상업적인 성공은 더 어려우므로 제약회사들이 적극적이지 않을 것은 사실 당연한 일이다. 미국에서 0~19세 사이의 소아암 환자 숫자는 약 1만6000 명으로 백혈병, 뇌종양이 약 반을 차지하며 신경아세포종, 림프종, 윌름씨 종양, 뼈와 연부 조직에 생기는 육종, 망막아세포종 등이 이에 속한다. 이중 12%의 환자가 사망하고 60%의 생존자가 장기적으로 합병증을 경험한다.
FDA는 지난 20년 동안 FDA 가 받은 소아암에 대한 NDA는 30개에 불과하고 29개가 승인을 받았으며, 이중 진짜 신약인 경우는 9건밖에 되지 않아 많은 개선이 필요함을 설명하고 있다. 실제 FDA는 2018년 FDARA (FDA 개정법) 안에 소아암을 치료하는 항암제 개발에 대해 제약사들의 의무를 규정하고 있으며 2020년 1월 이를 시행하지 위한 지침을 만들어 8월부터 발효를 시작했다. 이 안에 200 여개의 생물학적 표적을 지정하여 이들에 대한 항암제를 만드는 회사들은 의무적으로 소아암 프로그램을 만들어 임상개발을 하도록 정했다.

또한 소아암 환자들을 보다 적극적으로 성인 항암제 개발 프로그램에 포함시키기 위해 12세 이상의 소아 환자들을 성인 임상시험에 포함하도록 하는 지침, 표적항암제의 소아 임상 시험에 대한 지침 등을 만들어 제약 회사 및 바오텍 회사들이 동참하도록 권고한다.
FDA는 항암제 개발을 하는 회사들이 아주 조기의 임상 개발 시점부터 소아암을 위한 연구 계획을 제출하도록 하고, 여러 종류의 워크샵, 민관 협력 파트너쉽, 다 국가 법제 기관들의 협력 등 다각적 노력을 통해 소아암 치료제 개발을 독려하고 있다. 실제 최근 소아암 치료에 승인받은 약제들은 12세 이상의 소아암 환자가 성인 임상시험에 들어 감으로써 성인과 소아에 동시에 승인을 받았으며 앞으로 이런 약제들은 더 늘어날 것이다.
신약을 개발하는 회사들은 글로벌 임상개발을 통해 개발 물질이 빠른 시간 안에 시장 진입을 하기를 원한다. 개발 물질의 표적이 소아암에서 사용될 수 있다면 소아암 치료제로서의 개발 또는 성인 임상개발에 소아를 포함하는 프로그램을 개발하는 전략을 생각해 볼 수 있다. 이러한 시도는 FDA 에게 매우 환영과 친절한 지도를 받을 수 있는 기회를 부여할 것이다. 단, 소아를 포함하는 경우 약의 용량, 소아들에게 올 수 있는 장기적인 안전성 문제 등을 특별히 고려할 필요가 있다. 또한 미국 승인을 겨냥하는 경우 기회와 더불어 소아 임상개발에 대한 책임도 따른다는 것을 기억하여야 한다.


