"품목허가취소 절차에 임상시험계획승인 취소 불 포함"
메디톡스 진행 2건, 연구자 치료탐색 4건 등 6건 진행 중
메디톡스의 보툴리눔 톡신 제제 '메디톡신'이 허가 취소될 상황에 놓인지 두 달째이다. 메디톡신으로 하던 임상시험 프로젝트는 어떻게 되는 걸까"
이와 관련, 식품의약품안전처는 "메디톡신의 품목허가가 취소된다고 해서 메디톡신 임상시험 승인이 반드시 취소되는 건 아니다"라고 밝혔다.

식약처는 지난 달 17일 메디톡신주 △50단위 △100단위 △150단위에 대한 잠정 제조·판매 중지를 명령하고 의료인 등에게는 사용중단을 요청했었다.
검찰이 무허가 원액을 사용한 제품 생산, 원액 및 역가 정보 조작을 통한 국가출하승인 취득, 허가 내용 및 원액의 허용기준을 위반해 제품을 제조·판매하는 등 약사법을 위반한 메디톡스와 대표를 기소했기 때문이다.
식약처는 검찰로부터 관련자료를 제공받아 품목과 위반사항을 확인하고, 약사법 위반으로 메디톡신주 △50단위 △100단위 △150단위에 대한 품목허가 취소 절차에 착수했다. 아직 행정절차가 진행 중이다.
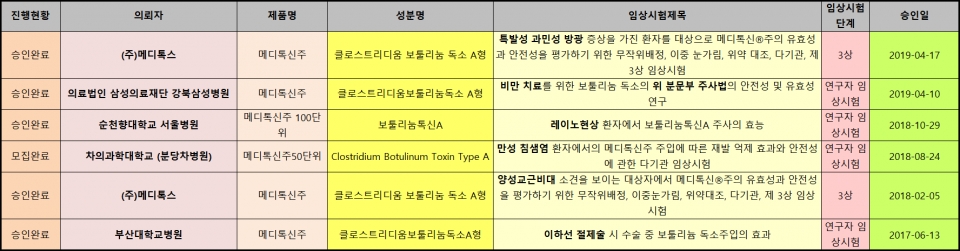
식약처 '의약품 안전나라' 임상시험 승인 정보공개 현황에 따르면, 9일 현재 '메디톡신'으로 진행중인 최근 3년 간 임상시험은 총 6건이다. 이미 종료됐거나 허가 취소 대상이 아닌 '메디톡신주200단위' 관련 임상시험은 제외한 집계다. 각각 연구자 임상시험 4건, 메디톡스가 직접 진행하는 임상시험은 2건이다.
연구자 임상시험과 메디톡스가 직접 진행한 임상시험의 특징은 다르다. 연구자 임상시험은 메디톡신 등 보툴리눔 톡신에 대한 특정 치료의 효과를 확인하기 위한 목적에서, 메디톡스의 임상시험은 메디톡신의 효능·효과를 추가하려는 목적성 임상이다.
부산대학교병원이 이하선 절제술 시 수술 중 보툴리눔 독소주입의 효과를 확인하기 위해 2017년 6월 승인받은 연구자 임상, 차의과학대학교 분당차병원이 만성 침샘염 환자에서의 메디톡신주 주입에 따른 재발 억제 효과와 안전성을 확인하려 2018년 8월 승인받은 연구자 임상이다.
또한 순천향대학교 서울병원이 레이노 현상에서 메디톡신주 100단위의 효능을 확인하기 위해 2018년 10월 연구자 임상을 승인받았고, 강북삼성병원이 비만 치료를 위한 보툴리눔 독소의 위 분문부 주사법의 안전성과 유효성을 평가하기 위한 연구자 임상을 2019년 4월 승인받았다.
이와 함께 메디톡스는 양성교근비대(사각턱) 소견을 보이는 대상자에서 메디톡신주 유효성과 안전성을 평가하는 임상 3상을 2018년 2월, 특발성 과민성 방광 증상을 가진 환자를 대상으로 유효성과 안전성을 평가하는 임상 3상을 2019년 4월 각각 승인받았다.
차의과학대학교 분당차병원의 만성 침샘염 환자 대상 임상만 환자 모집을 마쳤고, 이외 임상은 현재 모집 중이라는 게 식약처가 공개한 진행현황으로 파악된다.
그동안 메디톡스는 "보툴리눔 톡신 활용 분야가 광범위한 만큼 추가 적응증 확보를 위한 연구개발을 지속해 나갈 것이다"며 관련 임상시험 추진에 적극적인 입장이엇다.
다만, 현재로선 자사가 추진하던 임상시험과 연구자 임상시험 모두 자발적으로 중단한 상황으로 전해졌다.
김상봉 식품의약품안전처 바이오생약국장은 "파악해보니 자발적으로 중지한 것이라 다시 할 수는 있다"며 "품목허가취소 처분 절차를 밟고 있지만 임상시험계획승인 취소는 별개다. 관련 기준이 다르다"고 말했다.
품목허가 취소에 따른 행위는 특정적인 기간과 로트에 따랐으며, 해당 임상시험계획 승인과 연관성을 낮게 보고 있다는 판단이다.
김상봉 국장은 또 "메디톡신의 품목허가가 취소된다고 메디톡신으로 진행하던 임상시험계획승인이 자동적으로 취소되진 않을 것이다"며 "취소처분 절차 중 진행 중인 임상시험을 검토하고 있지만 품목허가 취소 처분 사유와 해당 임상연구들을 연결지을 수는 없다"고 밝혔다.
한편, 식약처는 코오롱생명과학의 골관절염치료제 '인보사케이주'의 임상시험계획 승인을 취소 처분 내린 바 있다. 코오롱생명과학은 그 즉시 처분 취소 소송을 제기해, 현재 진행 중이다.
인보사케이주 주성분 2액이 '연골유래세포'가 아님에도 '연골유래세포'로 임상시험계획을 승인 신청해, 승인받은 사실 때문이다. 식약처는 이를 '약사법' 제34조제1항에 의한 행정행위 성립상 '하자'로 보고 직권 취소했다.
식약처는 인보사 사례의 임상시험계획 승인 취소와 메디톡스의 사례를 다르게 보고 있는 것으로 보인다.
메디톡스의 약사법 위반 내용은 해당 기간과 로트에 한정됐다. 인보사의 약사법 위반은 주성분이 연골유래세포가 아님에도 시험계획 승인을 받은 행정행위 성립상 '하자'에 해당하기 때문이다.

