(2019.07.08~19) 식약처, 최근 2주간 임상시험 51건 승인
최근 2주간 50건이 넘는 임상시험이 승인됐다. 한미약품의 단장 증후군 바이오신약 후보물질 'HM15912(LAPSGLP-2 Analog)'는 이달 초 개발단계 희귀약에 지정된 데 이어, 임상 1상에 첫 진입 한다. 대웅제약의 아리셉트(도네페질) 패치제도 임상에 돌입한다.
21일 식품의약품안전처에 따르면 이달 8일부터 19일까지 총 51건의 임상시험이 승인됐다.
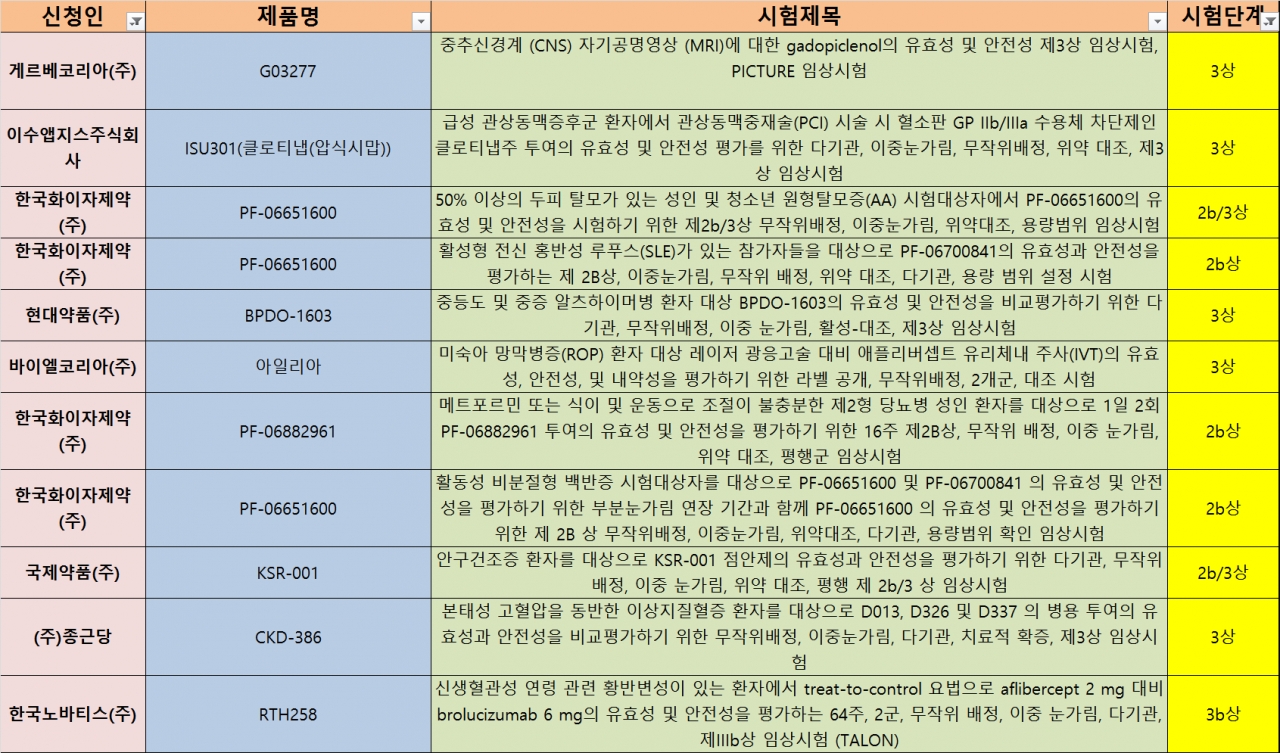
신청인(중복 포함)별로는 제약·바이오기업 38건, 병원 7건, CRO 6건 등으로 나타났다. 제약·바이오기업 중에서는 국내사 23곳, 다국적사 5곳이었다. 시험단계별로는 ▶ 생동성시험 17건 ▶ 1상 10건 ▶ 연구자 임상 7건 ▶ 3상 6건 ▶ 2b상 4건 ▶ 2b/3상, 2상 각 2건 ▶ 1/2a상, 3b상, 연장 각 1건 등으로 집계됐다.

한미약품이 개발 중인 단장 증후군 치료 바이오신약 'HM15912'는 지난 8일 건강한 자 대상 안전성과 내약성, 약동학을 평가하고 약력학을 탐색하는 임상 1상을 승인받았다. 단장 증후군은 선천성 또는 생후 수술적 절제로 전체 소장의 50% 이상이 소실돼 흡수 장애와 영양실조를 일으키는 희귀질환이다.
한미는 이 후보물질로 국내 임상을 처음 승인받았는데, 독자적 플랫폼기술인 랩스커버리(LAPSCOVERY)를 적용했다. 이에 체내 지속성과 융모 세포 성장 촉진 효과로 단장증후군 환자의 삶의 질을 개선할 것으로 회사 측은 내다봤다. 주 1회 투여하는 지속 GLP-2 Analog로 개발 중이다.
화이자는 신약후보 물질 'PF-06651600'를 통해 지난 10일 활동성 비분절형 백반증 환자 대상 임상 2b상에 이어 16일 활성형 전신 홍반성 루푸스(SLE) 환자 대상 임상 2b상, 17일 원형탈모 환자 대상 2b/3상을 각각 승인받았다.
PF-06651600는 경구용 야누스 인산화효소(JAK3) 선택적 저해제로 면역과 염증 조절을 관리하는 효소다. 류마티스성 관절염, 크론병 등 자가면역질환과 관련이 있는 것으로 알려져 여러 임상을 시도할 수 있다.
치매 치료에 쓰이는 '도네페질' 성분의 패치제가 시판되지 않은 상황에서 대웅제약도 개발 경쟁에 뛰어들었다. 지난 15일 대웅은 'DWJ1365'에 대한 임상 1상을 승인받았다. DWJ1365는 도네페질 성분 개량신약으로 제형을 정제에서 패치제로 바꿨다.
패치제 단회 부착과 대조약인 '아리셉트 정 10mg' 7일 반복 경구 투여 시 약동학적 특성을 비교한다. 국내사 중 아이큐어가 가장 앞서 3상을, 보령제약과 동아ST가 1상 중이었다. 아이큐어의 패치제는 주 2회 부착해야 하는데, 동아와 대웅의 후보물질은 주 1회 부착 가능해 편의성 면에서 강점이 있다.
이와 관련 식약처는 지난해 '알츠하이머형 치매 치료를 위한 경피흡수제 개발 관련 질의·응답집'을 통해 "혈중 약동학 평가변수(AUC, Cmax등)와 임상적 평가변수와의 상관관계, 경피 흡수제와 경구제 간 반복투여 시 항정상태에서 생동성이 입증되면 3상은 필요하지 않을 것으로 사료된다"고 한 바 있다.
아이큐어는 3상까지 모두 진행했으나, 동아와 대웅에게는 1상 이후 시판허가까지의 기간이 단축될 수 있는 희소식이 됐다.
현대약품도 치매(알츠하이머) 복합제 개발에 속도를 높였다. 'BPDO-1603'이라는 코드명으로 알츠하이머 환자 대상 유효성 및 안전성을 평가하는 3상을 승인받았다. 기존 치료제인 에자이 아리셉트(도네페질), 룬드벡 에빅사(메만틴)의 복합제다. 종근당도 뒤이어 도네페질+메만틴 복합제 1상을 진행 중인 것으로 알려졌다.
황반변성 치료제 시장에서 강세를 보이던 바이엘은 기존 판매 품목인 아일리아를, 노바티스는 신약후보물질 브롤루시주맙의 임상을 각자 착수했다.
바이엘은 아일리아를 가지고 지난 15일, 미숙아 망막병증(ROP) 환자 대상 레이저 광응고술 대비 애플리버셉트 유리체내 주사(IVT)의 유효성, 안전성, 및 내약성을 평가하기 위한 3상을 승인받았다. 미숙아의 실명을 적절한 시기에 예방하는 적응증을 확보하기 위한 임상으로 보인다.
노바티스는 RTH258(브롤루시주맙)을 신생 혈관성 연령 관련 황반변성을 치료하기 위한 3b상을 승인받았다. 브롤루시주맙에 대한 전 세계 연구 결과, 아일리아 대비 최대 교정시력에 대한 비열등성을 입증하며 미국 내 발매를 준비 중이다.
3년여간 국내에서 당뇨병 황반부종과 신생 혈관성 연령 관련 황반변성을 대상으로 임상 3상을 진행해왔다.
국제약품의 안구건조증 치료제 'KSR-001'은 2b/3상 임상에 착수한다. 오리지널은 오츠카제약이 개발한 무코스타점안액(레바미피드)인데 이 약물의 부작용을 개선하는 개량신약을 선보인다는 계획이다. 국제 측은 2021년 상반기에 제품을 출시할 것으로 기대하고 있다.
강스템바이오텍은 아토피피부염 줄기세포 치료제 '퓨어스템AD'에 대해 중증도 이상의 만성 환자를 대상으로 2건의 임상을 승인받았다. 지난 8일 반복투여의 안전성 평가 및 유효성 탐색을 위한 1/2a상에 이어 지난 15일 K0104 임상시험(장기추적관찰)의 연장연구였다.
강스템바이오텍은 지난달 말 임상 3상을 마쳤고, 6개월 간 추적관찰을 통해 내년 초 식약처에 품목허가를 신청한다는 계획이다. 퓨어스템AD주는 줄기세포를 제대혈에서 분리, 배양하는 기술 기반 중증도 이상의 아급성·만성 아토피 피부염 치료제로 개발되고 있다.
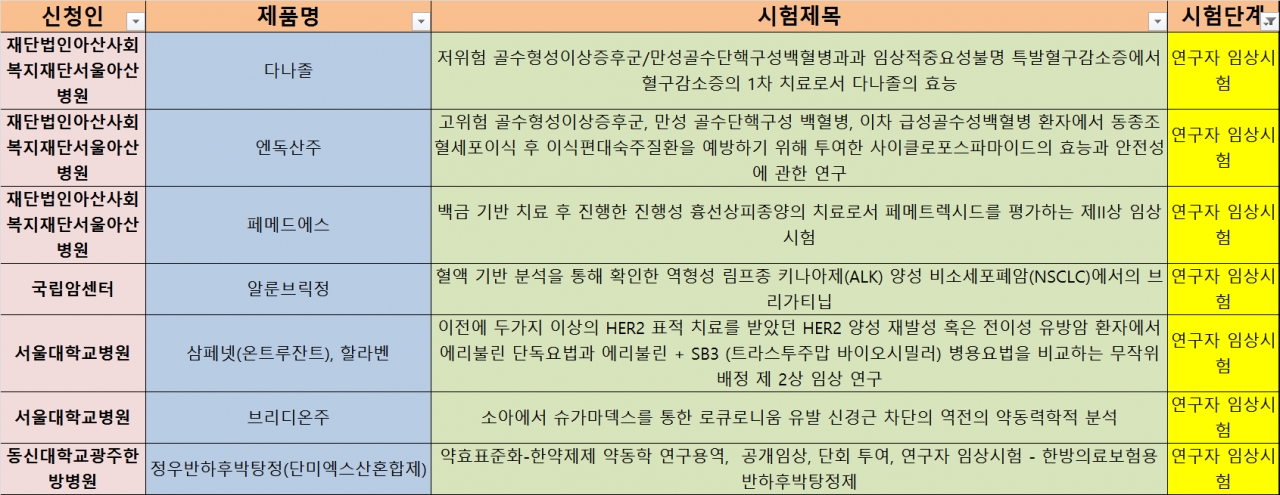
지난 2주간 생동성 시험계획을 승인받은 사례, 연구자 임상시험 진행 사례, 시험단계별로 구분한 제약바이오기업과 CRO의 임상시험 계획 승인 사례는 다음과 같다.